Ozon : Ein Stoff mit zwei Gesichtern – Teil 1: Luftschadstoff und Sommersmog
Was ist Ozon? Wie entsteht schädliches Ozon? Wann kann Ozon uns schaden? Wann (und wo) ist Ozon für uns lebenswichtig? Und wann ist Ozon ein Heilmittel?
Von Ozon hat sicher jeder schon gehört, und es wurden haufenweise Bücher darüber geschrieben. Warum also über Ozon schreiben? Während der Recherche für diesen Artikel bin ich in der Zentralbibliothek in Zürich gewesen und habe festgestellt, dass der Recherchecomputer mich auf der Suche nach Ozon fast immer ins Magazin mit den Erscheinungen vor 2010 hinunter schickt. Ist das Thema demnach in den letzten Jahren tatsächlich ins Abseits unseres Gedächtnisse geraten? Dabei sind gerade heute die unangenehmen Auswirkungen von Ozon in unserer Atemluft wieder einmal spürbar.
So dreht sich der erste Teil dieses Doppel-Artikels um Ozon als Luftschadstoff, während der zweite Teil euch die nützlichen und sogar für uns lebenswichtigen Eigenschaften dieses Stoffs mit zwei Gesichtern näherbringen soll.
An einem heissen Tag im Juli…
Es ist der 2.7.2015, die Sonne strahlt ungetrübt auf Mitteleuropa hinab. Heute ist ein Werktag. Die Städte sind belebt, es wird gearbeitet, die Strassen sind voller Autos. Und die Tageshöchsttemperaturen reichen in der Region Zürich bis 34°C. Ich habe das Glück in einem Dorf am Zürichsee zu sitzen und mir die Live-Messdaten für Schadstoffe in der Luft in Zürich und vielen Städten Deutschlands im Netz ansehen zu können. Da muss ich mir wegen dem, was ich da sehe, eigentlich weniger Gedanken machen. Die Leute, die in der Stadt unterwegs sind, aber schon.
In Zürich werden heute um die Mittagszeit Stundenmittelwerte von bis zu 174 μg Ozon pro m³ gemessen. In vielen Städten in West- und Südwestdeutschland sind gestern bereits Spitzenwerte um die 200 μg Ozon pro m³ gemessen worden. In Baden-Baden ganz im Süden Baden-Württembergs ist bei über 240 μg Ozon pro m³ sogar Ozon-Alarm ausgelöst worden!
Wer sich bei solchen Konzentrationen draussen bewegt, kann mit Kratzen und Brennen im Hals, Kopfschmerzen und Augenbrennen zu tun bekommen. Diese Symptome haben nicht unbedingt mit einer Sommergrippe zu tun, sondern mit einer Anreicherung des Gases Ozon in der Luft. Denn wir sind für Ozon-Konzentrationen von nur 40 – 80 μg Ozon pro m³ geschaffen…. Aber von Anfang an:
Was ist Ozon?
Ozon ist eine besondere Form (Chemiker sagen „Allotrop“ dazu) des Elements Sauerstoff. Während die üblichen Sauerstoff-Moleküle (O2), die wir atmen, aus je zwei Sauerstoff-Atomen bestehen, besteht ein Ozon-Molekül aus drei Sauerstoffatomen (O3). Deshalb wird Ozon manchmal auch „Trisauerstoff“ genannt.
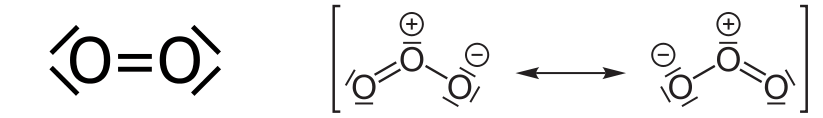
Die Strukturformeln von Luftsauerstoff (links) und Ozon (rechts).
Die wahre Struktur des Ozon-Moleküls liegt in der Mitte zwischen den beiden gezeigten Formeln, d.h. beide Bindungen sehen gleich aus und das Molekül ist symmetrisch! Da man in der Formelsprache aber keine 1,5-fach-Bindungen zeichnen kann, geben die Chemiker solche mesomeren Grenzformeln an und meinen „die Wahrheit ist in der Mitte“.
Das Ozon-Molekül ist zudem elektrisch ungeladen. Die gezeigten Formalladungen ergeben sich aus den chemischen Spielregeln für die Verteilung der Elektronenpaare (Striche) auf die Atome und ergeben beim Ozon in der Summe eine Ladung von Null.
Allerdings deutet das Vorhandensein von Formalladungen in der Strukturformel schon darauf hin, dass wir es mit einem reaktionsfreudigen Molekül zu tun haben.
Ozon ist, ähnlich wie der Atem-Sauerstoff, ein farbloses bis bläuliches Gas. Dass Ozon nicht zum Atmen taugt, merkt man bei grösseren Mengen allerdings schnell, denn es hat einen unangenehm stechenden, chlorähnlichen Geruch, wie du ihn vielleicht von älteren Fotokopierern oder Laserdruckern kennst. Dieser Geruch kommt nicht von ungefähr, denn Ozon wirkt stark oxidierend und ist dabei alles andere als wählerisch: Es geht mit vielen Stoffen Redox-Reaktionen ein – auch mit den Bestandteilen von Menschen bzw. ihrer Atemwege. Deshalb wird Ozon von den Gefahrstoffexperten als sehr giftig gekennzeichnet.
Nichts desto trotz ist Ozon ein natürlicher Bestandteil unserer Atemluft. Allerdings kommen in der Troposphäre, genauer der planetaren Grenzschicht, dem untersten Teil der Atmosphäre, den wir atmen, in der Natur nur 40 – 80 μg Ozon pro m³ Luft vor. Das entspricht an einem angenehm warmen Tag 40 bis 80 Millionstel Gramm in rund 1,2 Kilogramm Luft!
An diese kleinen Mengen haben sich unsere Körper im Lauf der Jahrhunderttausende langen Geschichte unserer Entwicklung angepasst. Steigt die Ozon-Konzentration jedoch in kurzer Zeit auf über etwa 100 bis 120 μg/m³, wird es unangenehm, und ab etwa 180 bis 200 µg/m³ über mehrere Stunden zunehmend gesundheitsschädlich. Deshalb können wir Ozon in der Atemluft gar nicht brauchen. Deshalb hat die Schweizer Regierung bestimmt, dass die Ozon-Konzentration in der Atemluft nicht über 120 µg/m³ liegen darf. In den EU-Staaten sind sogar nur 110 µg/m³ erlaubt. Und trotzdem werden diese Grenzwerte immer noch sehr oft überschritten.
Wie entsteht Ozon in der Troposphäre?
Wie es dazu kommt, dass sich Ozon in unserer Atemluft ansammelt? Das haben wir uns selbst zuzuschreiben. Zumindest dann, wenn wir mit einem Auto oder anderen Kraftfahrzeug mit Verbrennungsmotor durch die Gegend fahren (oder fliegen), oder unseren Strom mit einem Dieselaggregat herstellen. Denn damit diese Motoren laufen und etwas antreiben können, muss es in ihnen so heiss werden, dass neben dem Treibstoff auch der Stickstoff aus der Luft (und die besteht zu 70% aus Stickstoff!) verbrannt wird. Dabei entsteht aus Stickstoff, der mit Sauerstoff reagiert, das Gas Stickstoffmonoxid (NO):
Normalerweise ist Stickstoff sehr reaktionsträge, d.h. er reagiert freiwillig gar nicht gerne und brennt deshalb auch nur, wenn man ihm ordentlich einheizt. (Wer sich bereits am Flughafen mit Le Châtelier unterhalten hat, dem kommt das vielleicht bekannt vor: Ja, die Reaktion ist Teil eines Gleichgewichts, das im Kolben eines Motors durch einen Zwang, die hohe Temperatur, auf die rechte Seite verschoben wird!) Entsteht dabei erst einmal Stickstoffmonoxid, dann reagiert dieses Gas auf dem Weg durch den Auspuff nach draussen mit mehr Sauerstoff schnell zu Stickstoffdioxid (NO2) weiter.
Das Gas Stickstoffdioxid ist nicht nur seinerseits sehr giftig (das ist eine andere Geschichte…), seine Moleküle sind auch empfindlich gegen Sonnenlicht. So kann ein NO2-Molekül, das von Licht getroffen wird, auseinander fallen:
Wer im Chemie-Unterricht aufgepasst oder sonst Ahnung von Chemie hat, mag jetzt protestieren: Sauerstoff-Atome kommen doch nicht einzeln vor! Deshalb sucht sich dieses Sauerstoff-Atom auch schleunigst ein neues Molekül, mit dem es reagieren kann. Und da Luft zu 78% aus reaktionsträgem Stickstoff und zu gut 20 Prozent aus molekularem Sauerstoff (O2) besteht, ist dieses neue Molekül in der Regel Sauerstoff:
Dies ist der einzige, aber reichlich begangene Weg, auf dem in unserer Atemluft Ozon entsteht. Deshalb steigt die Ozon-Konzentration im Laufe des Vormittags, nachdem sich zahllose Auto- und Lastwagenfahrer auf den Weg zur Arbeit gemacht und reichlich Stickstoffdioxid hinterlassen haben, an sonnigen Tagen schnell an. Und diese Ozon-Ansammlung bleibt uns erhalten, bis die Sonnenstrahlung nachlässt und die Motoren im Feierabendverkehr reichlich neues Stickstoffmonoxid erzeugen, welches statt mit Sauerstoff auch mit dem reaktionsfreudigeren Ozon reagieren kann:
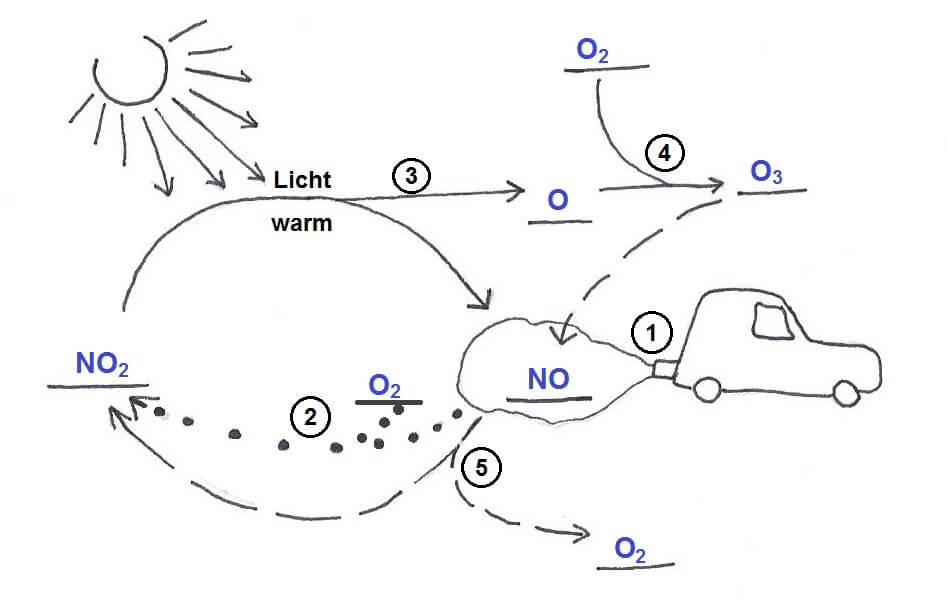
Stickstoffoxide aus Autoabgasen führen zur Entstehung von Ozon:
(1) Kraftfahrzeuge stossen Stickstoffmonoxid aus. Im Berufsverkehr am Morgen und am Abend entsteht besonders viel Stickstoffmonoxid.
(2) Stickstoffmonoxid wird vom Luftsauerstoff oxidiert: Es entsteht Stickstoffdioxid.
(3) Wenn es warm ist, spalten Sonnenstrahlen ein Sauerstoffatom aus dem Stickstoffdioxid ab.
(4) Das Sauerstoffatom reagiert mit Luftsauerstoff zu Ozon.
(5) Wenn Ozon auf Stickstoffmonoxid trifft, reagieren sie miteinander: Es entstehen Sauerstoff und Stickstoffdioxid.
Wie du dich vor Ozonbelastung schützen und die Ozonentstehung verhindern kannst
Deshalb empfehlen Umweltbehörden, wie z.B. das deutsche Umweltbundesamt, an Ozon-reichen Tagen erst am späten Nachmittag und Abend Sport zu treiben. Wer darüber hinaus der Ozonbelastung entkommen möchte, sollte sich z.B. im Wald aufhalten: Dort sind meistens wenig bis keine Autos und es ist schattig.
Richtig problematisch wird das Ozon in der Atemluft allerdings, wenn zu allen genannten Umständen eine Inversionswetterlage kommt: Dann liegt eine wärmere Luftschicht über der Schicht, die wir atmen, und hält diese förmlich in Bodennähe fest. Die in den Städten entstehenden Luftschadstoffe – auch das Ozon – können sich nun nicht einmal mehr nach oben hin verteilen. Dieses so angestaute, dunstig-giftige Luftgemisch wird als Sommersmog bezeichnet. Der Begriff kommt aus den USA und setzt sich aus den englischen Wörtern „smoke“ (Rauch) und „fog“ (Nebel) zusammen. In den 1940er-Jahren, als man noch kaum etwas über Ozon wusste, mussten die Bewohner von Los Angeles als erste dieses Phänomen erleben: Der höchste damals dort gemessene Spitzenwert betrug sage und schreibe 1160 μg Ozon pro m³ !
Um solche gemeingefährlichen Ozon-Konzentrationen erst gar nicht mehr entstehen zu lassen, stattet man heute die Autos mit einem 3-Wege- oder einem Denox-Katalysator aus. In so einem Gerät laufen Reaktionen ab, welche einen grossen Teil der Stickstoffoxide aus dem Abgas entfernen, bevor es nach draussen gelangt und zur Ozonentstehung führen kann (Aber das ist eine andere Geschichte….).
Da jedoch auch solche Katalysatoren niemals perfekt arbeiten, kannst du selbst den wirksamsten Beitrag zur Verminderung der Ozon-Konzentration leisten: Fahre -besonders an warmen Sommertagen- nur wenn unbedingt nötig Auto. Mit den öffentlichen Verkehrsmitteln kommt man im Stadtverkehr ohnehin meist viel entspannter durch.
Warum wir trotz allem nicht ohne Ozon leben können
Wie Ozon in die Stratosphäre kommt und uns vor gefährlicher UV-Strahlung schützt, was das Ozonloch ist, und in welcher Weise Ozon heilsam sein kann, erfährst du im zweiten Teil dieses Doppel-Artikels!
Und was tust du bei oder gegen Ozon-Belastung?
(Titelbild: Bearbeitung von Creator:Fidel Gonzalez (Eigenes Werk) [CC BY-SA 3.0 oder GFDL], via Wikimedia Commons)



















Mal wieder ein sehr spannend geschriebener Artikel bei dem ich Historiker die Entstehung von Ozon verstehe.
Das freut mich ungemein, zeigt das doch einmal mehr, dass mein Konzept aufgeht :).
21% Luftsauerstoff und 79% Sickstoff, dazwischen Kleinteile wie CO2, Wasserstoff, Helium und Zeug. Bitte bei den Fakten bleiben. Stickoxide verbinden sich mit Wasser in der Atmosphäre zu HNO2, HNO3, das ist Salpetersäure, der sogenannte saure Regen. Das wusste man schon vor 30 Jahren, ich glaub nicht das sich da was geändert hat. Ozon reflektiert Kosmische Strahlung aus dem All und schützt uns vor dem Verbrennen. Das Ozonloch wurde schon wieder vergessen ? Stickoxide NOx entstehen nur bei heissen Verbrennungen meist Dieselfahrzeuge und werden bei modernen Fahrzeugen über die Redoxreaktion mit Harnstoff NOx + 2NH3 = 2N2 + 3H2O wieder in Stickstoff und Wasser umgewandelt. Mit vermehrter Reaktion zu O3 habe ich noch nie gehört. Panikmache.
Entschuldige bitte das verspätete Freischalten des Kommentars und die noch spätere Antwort darauf. In der Ferienzeit ist mir einiges liegen geblieben.
Etwas als Panikmache zu bezeichnen, weil es dir bislang unbekannt war, halte ich für ziemlich leichtfertig. Die Atmosphärenchemie, wie ich sie hier (auszugsweise!) beschreibe, wird so an der ETH bzw. Uni Zürich gelehrt. Dort gehören natürlich auch die Reaktionen der Stickstoffoxide zu Salpeter- und Salpetriger Säure und andere dazu, die hier aber nicht zum Thema gehören. Über sauren Regen, der ein ganz eigenes Thema ist, habe ich noch nicht geschrieben, aber ich danke dir für die Anregung, dies bei Gelegenheit nachzuholen.
Die Entstehung von saurem Regen hat man ebenso wie die Ozonentstehung in der untersten Atmosphärenschicht in den letzten Jahrzehnten durch den Einsatz von DeNOx- (denen mit der Harnstoff-Reaktion) und anderen KFZ-Katalysatoren deutlich vermindern können.
Doch auch der Abbau der Stickstoffoxide in den Katalysatoren verläuft nie vollständig, wie die erhöhten Ozon-Messwerte an den heissen Tagen 2015 und übrigens auch 2018 zeigen (wenngleich die gegenüber den Spitzenwerten aus den 1990er Jahren noch überschaubar sind). Zudem beruht der ganze Auto-Abgas-Skandal der letzten Jahre genau darauf, dass die Reaktionen in den Katalysatoren noch weniger vollständig abliefen/-laufen, als die Autohersteller uns weismachen wollten (mein Artikel zu den Autokatalysatoren ist auch in diesem Artikel verlinkt).
Für um so wichtiger halte ich, dass nicht in Vergessenheit gerät, dass Katalysatoren die Abgasprobleme der Verbrennungsmotoren nicht restlos aus der Welt schaffen. Und eben dies bewusst zu machen, war eine wichtige Intention, mit welcher ich diesen Artikel geschrieben habe.
Um dieser Intention gerecht zu werden, bin ich auch bezüglich der Atmosphärenzusammensetzung den Fakten treu genug geblieben. Für das Verständnis der gezeigten Reaktionen ist nämlich von vornehmlicher Bedeutung, dass Sauerstoff der mit Abstand am häufigsten vertetene potentielle Reaktionspartner für neu entstehende Sauerstoff-Atome bzw. -radikale ist (ob man nun von 78% oder 79% Stickstoff ausgeht, ist O2 rund 20 mal häufiger anzutreffen als alle übrigen Luftbestandteile zusammen!).
Das Ozon in hohen Luftschichten und das Ozonloch habe ich übrigens nicht vergessen, sondern ihm einen eigenen Artikel gewidmet, der am Ende dieses Artikels hier verlinkt.
Ich wünsche viel Spannung beim Weiterlesen,
Kathi „Keinstein“