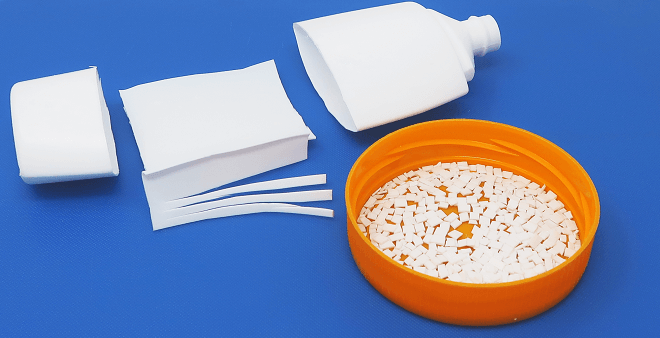
Ruhrpott, Deutschland, 2006: Reto, ein waschechter Schweizer und mein damals neuer Liebster, ist zu Besuch an meinem Studienort. Was mir traurig, wenn auch alltäglich erscheint, schockiert ihn zutiefst: Den überall herumliegenden Abfall ist er aus der Schweiz nicht gewohnt – zumindest nicht in solchen Mengen. Besonders Kunststoff-Verpackungen fallen uns vielerorts ins Auge. Dabei gibt es schon seit meiner Kindheit die „gelbe Tonne“ und dahinter ein ausgefeiltes Recycling-System. Ganz zu schweigen von all den Abfalleimern im öffentlichen Raum.
Wenige Jahre später habe ich die Seiten gewechselt und musste Reto bald recht geben: Was die Abfall-Entsorgung betrifft, sind die Schweizer generell ordentlicher als meine Landsleute. Nach 10 Jahren unter den Eidgenossen wird allerdings deutlich: Auch hier wird Littering zunehmend zum Problem.
Da braucht es gar keine Horrorbilder und -meldungen von verschmutzten Stränden und Plastik in Tiermägen und dem Marianengraben, um zu begreifen, dass wir ein Problem haben.
Recycling – das Thema ist ein Dauerbrenner
Eigentlich haben wir gleich zwei Probleme:
- Klassische Kunststoffe sind Erdölprodukte. Sie werden also aus einem fossilen Rohstoff hergestellt, der irgendwann zur Neige geht.
- Klassische Kunststoffe werden kaum bis gar nicht biologisch oder von den Naturkräften abgebaut.
Beide sind nichts neues, sondern uns seit Jahrzehnten bewusst. Deshalb tüfteln Forscher und Ingenieure ebenso lang schon an Methoden, „verbrauchtes“ Plastik wieder zu verwerten. Sie entwickeln Verfahren und bauen Recycling-Kreisläufe immer weiter aus. Die Schweizer bezeichnen sich gar als Weltmeister im Recycling von Abfällen – auch von Kunststoffen.
Aber welche Kunststoffe können wirklich recycelt werden? Wie funktioniert das? Wie könnt ihr zum nachhaltigen Umgang mit Plastik beitragen?
Welche Kunststoffe sind recycelbar?
Am einfachsten wiederverwendbar sind möglichst reine Stoffe. Ein Material, das aus nur einem Stoff besteht, hat nämlich durchgehend die gleichen Eigenschaften und kann mit einem einzigen, daran angepassten Verfahren behandelt werden. Das gilt auch für Verbundmaterialien, deren einzelne Bestandteile sich leicht voneinander trennen lassen.
Nicht trennbare Verbundmaterialien und Kunststoffe, die mit vielen Zusatzstoffen, sogenannten Additiven (z.B. für Farbeffekte, Weichmacher, Brandschutz,…), vermischt sind, lassen sich nur schlecht oder gar nicht wiederverwenden.
Thermoplaste als Recycling-Favoriten
Besonders für eine Wiederverwertung geeignet sind jene Kunststoffe, die bei hohen Temperaturen weich und formbar werden – die sogenannten Thermoplaste. Die kann man nämlich schreddern, erhitzen und zu neuen Gegenständen formen, ohne dass sich ihre Moleküle dabei verändern (zumindest im Optimalfall).
Zu den Thermoplasten gehören auch die verbreitetsten Alltagskunststoffe Polyethylenterephthalat (PET), Polyethylen (PE) und Polypropylen (PP) (Einzelheiten zu diesen Stoffen erfahrt ihr im Plastik-1×1 hier in Keinsteins Kiste). Da verwundert es nicht, dass gerade diese Kandidaten die grösste Rolle beim Recycling von Alltagsabfällen spielen. Allerdings gelingt auch das nur dann wirklich gut, wenn die Hersteller schon bei der Erstverarbeitung dieser Kunststoffe auf die Recyclingfähigkeit achten. Wie das geht, verraten Guidelines für die Industrie, verfasst von den Recycling-Verantwortlichen.
Auch Polyvinylchlorid (PVC) ist ein Thermoplast. Bei diesem Kunststoff gestaltet sich das Recycling (wie auch die Verwendung im Lebensmittelbereich) schon kniffeliger, weil er in vielfältiger Form verwendet wird und (besonders als Weich-PVC) kaum ohne Additive auskommt. Trotzdem wird auch PVC recycelt, wenn auch vornehmlich im Bauwesen, wo grössere Mengen gleichartigen PVC-Materials anfallen.
Und was ist mit kompostierbaren Biokunststoffen?
Was nach der ultimativen Verwertbarkeit bzw. Entsorgung klingt, hat oft einen beachtlichen Haken. Biopolymere sind aus Kettengliedern zusammengesetzt, die Lebewesen entlehnt sind, wie die Milchsäure-Glieder des Polylactids (PLA). Damit sind sie grundsätzlich für den Abbau durch Lebewesen oder deren Bestandteile geeignet.
In der Praxis sind dafür aber oft Bedingungen nötig, die ein Komposthaufen oder die freie Natur nicht bieten. PLA ist beispielsweise nur in speziellen Anlagen bei unnatürlichen Temperaturen abbaubar. So macht PLA zur Abfallvermeidung bislang nur dann Sinn, wenn der Anbieter – zum Beispiel ein Park mit Imbissbetrieb – direkt mit einem PLA-Entsorger (und bestenfalls -Wiederverwerter) zusammenarbeitet.
Wie wird recycelt?
Kunststoffe kann man grundsätzlich auf zwei Arten wiederverwerten:
- Werkstoffliche Verwertung: Das Material (die Polymer-Ketten als solche bleiben (weitestgehend) intakt und werden nur zu neuen Gegenständen geformt. Das ist der wohl wünschenswerteste Weg, da so der grösste Teil des zur Herstellung des Kunststoffs getätigten Aufwands nicht noch einmal nötig ist. Für diesen Weg geeignet sind im Besonderen die Thermoplasten unter den Kunststoffen. In der Praxis sind solche Verfahren leider meist nicht unendlich wiederholbar: Die Polymere überstehen das Erhitzen oft nicht gänzlich unbeschadet, sodass das Recycling-Material oft eine weniger gute Qualität als der Kunststoff bei der Erstverwendung hat. Fachleute nennen diesen Effekt deshalb „Downcycling“.
- Rohstoffliche Verwertung: Die Polymerketten werden dabei gezielt zerlegt. Die entstehenden Kleinmoleküle sind nach wie vor wichtige Energieträger und können als Brennstoffe oder Rohmaterial für andere Erdölprodukte verwendet werden.
So werden einzelne Kunststoffe recycelt
PET (Polyethylenterephthalat)
In der Schweiz gibt einen einzigartigen, geschlossenen PET-Recycling-Kreislauf: Überall in der Öffentlichkeit findet man hier blau-gelbe Sammelbehälter für PET-Getränkeflaschen – in Geschäften, an Bahnhöfen, bei Veranstaltungen, in Parkanlagen, an Abfall-Sammelstellen und anderswo. Die darin gesammelten Flaschen können farblich sortiert und nach Abtrennung von Fremdstoffen zu Pressballen verarbeitet werden, die rund 98% reines PET ihrer jeweiligen Farbe enthalten. Infrarot-Technik und Laser machen es möglich.
Diese PET-Abfälle werden weiter gereinigt, zu Flocken geschreddert und von den Flaschendeckeln getrennt. Letztere bestehen nämlich aus PE, welches – anders als PET – weniger dicht als Wasser ist und folglich darauf schwimmt. Die PET-Flocken sinken derweil auf den Grund (Chemiker und Physiker nennen dieses Trennverfahren Sedimentation), sodassman die PE-Deckel einfach abgiessen oder abschöpfen kann.
Nach weiterer Reinigung sind die Flocken schliesslich so sauber, dass sie als Lebensmittel-Verpackungsmaterial zulässig sind. Dann werden sie eingeschmolzen und zu sogenanntem Re-Granulat, einem groben Kunststoff-Gries, verarbeitet. Als Thermoplast kann dieser PET-Gries schliesslich bei 250°C zu neuen Gegenständen zusammengesinter werden – zum Beispiel zu dickwandigen „PET-Rohlingen“, die, bereits mit Gewinde und Deckel versehen, eine Flasche erahnen lassen.

In dieser platzsparenden Form werden die Rohlinge oder „Preforms“ an die Getränkeabfüller (oder auch an Geocaching-Begeisterte, die darin ihre Schätze verstecken) geliefert. In der Abfüll-Anlage werden die Rohlinge erneut erhitzt und zu fertigen Getränkeflaschen aufgeblasen.
So effektiv geht PET-Recycling
Der Betreiber des PET-Kreislaufs – im Übrigen ein Verein, also nicht-staatlich und nicht gewinnorientiert – behauptet, bei der Wiederverwertung von PET-Getränkeflaschen finde kein Downcycling statt. Zudem betrage die Recyclingquote für PET in der Schweiz mittlerweile 82%! Bei freiwilliger Beteiligung der Getränkehersteller und Abfallsammler wohlgemerkt. Das hält die Regierung, die ein Minimum von 75% zum Ziel erklärt hat, bis dato davon ab, ein Pfandsystem einzuführen.
Polyethylen und Polypropylen (PE bzw. PP)
Auch PE und PP sind Thermoplaste. So kann man sie in ähnlicher Weise wie PET-Flaschen verwerten. Allerdings erweichen sie bei wesentlich niedrigeren Temperaturen (PE schon ab 80°C, PP bleibt noch etwas weiter fest) und würden sich bei 250°C längst zersetzen. Deshalb sind für das Recycling von PE und PP jeweils eigene Kreisläufe und Anlagen nötig, um diese Kunststoffe gemäss ihren Eigenschaften zu behandeln.
Ausserdem kommen nur dafür geschaffene PE- und PP-Produkte für die Wiederverwertung in Frage. Und selbst dann geht das Einschmelzen in der Regel mit einem Downcycling einher. So kann beim Recycling von PE oder PP meist kein Material mit Lebensmittelqualität gewonnen werden. R-PE und R-PP kommen daher vornehmlich im Bauwesen, in Nicht-Lebensmittelverpackungen, der Landwirtschaft, in Fahrzeugen oder Elektronik zum Einsatz.
EPS/Styropor = „Quietschpapier“
Diese Form von Polystyrol (EPS steht für „Expandiertes Polystyrol“) birgt ein ganz besonderes Problem: Das Material, das wir als massgeschneiderte, stosssichere Verpackung oder Wärmedämmstoff kennen, besteht zu 98% aus eingeschlossener Luft und nur zu 2% aus dem eigentlichen Kunststoff und seinen Additiven. Das Ganze ist also ein enormer Platzfresser!
Der Transport zu einer Mühle, in der Styropor zermahlen und anschliessend zu Re-Granulat eingeschmolzen werden kann, braucht daher ein enormes Volumen für reichlich wenig Kunststoff-Masse. Trotzdem wird das gemacht und das Granulat kommt vornehmlich für Einsätze im Bauwesen zur Verwendung.
Um dem Transportproblem zu begegnen, hat das Fraunhofer-Institut für Verfahrenstechnik und Verpackung IVV ein neues Recycling-Verfahren für EPS entwickelt (und CreaSolv® getauft). Die Abfälle sollen dabei noch an der Sammelstelle in ein Lösungsmittel, das möglichst nur Polystyrol auflöst, eingebracht werden. Dabei entweicht die ganze Luft und Beistoffe können später leicht abgetrennt werden. In der Lösung nimmt die Kunststoffmasse nur 1/50 des Raumes ein, den das ursprüngliche EPS bräuchte, was den Transport erheblich erleichtert.
Getränkekartons
Das ist auch mir neu: In der Schweiz können auch Getränkekartons („Tetrapak“) recycelt werden. Tatsächlich tragen solche, die man in den grossen Supermärkten bekommt, das Kennzeichen „für den Restmüll“. Erst bei der Recherche für diesen Artikel bin ich bei Swiss-Recycling zufällig auf den – einmal mehr privaten – Anbieter für die Wiederverwertung von Getränkekartons gestossen. Bislang gibt es nur 100 Sammelstellen, aber die nächste ist nur wenige Dörfer weiter. Da führe ich die Tetrapak-Trennung doch gleich bei uns im Haushalt ein. Anbei: Ja, es stimmt: Abfalltrennung ist hier in der Schweiz eine besondere Spezialität.
Warum ist das Tetrapak-Recycling nicht weiter verbreitet?
Getränkekartons sind ein typisches Verbundmaterial: Pappe, Kunststoff- und Aluminiumschichten sind darin fest miteinander verklebt. Das schützt den Inhalt und ist für feuchtfröhliche Experimente nützlich, aber ganz kniffelig zu recyceln.
Immerhin können die Pappfasern aus den alten Kartons herausgelöst und zu Wellpappe verarbeitet werden. Kunststoff und Aluminium werden dann als Brennstoff für die Erzeugung von Fernwärme oder Strom eingesetzt – wie übrigens auch der Restmüll oder -kehricht hierzulande.
So könnt ihr zum Recycling beitragen
In Deutschland und Österreich werden wiederverwertbare Kunststoffe gemischt gesammelt. Verpackungen, die als rezyklierbar gelten, tragen als Kennzeichen den „grünen Punkt“. Ihr könnt sie – möglichst sauber – in die gelbe Tonne bzw. den gelben Sack entsorgen, deren Inhalt die Müllabfuhr regelmässig abholt.
In der Schweiz ist, wie bereits erwähnt, viel Eigeninitiative gefragt. PET-Getränkeflaschen könnt ihr in die blau-gelben-Behälter an öffentlichen Sammelstellen werfen, um sie in den PET-Kreislauf zurückfliessen zu lassen. PE- und PP-Flaschen werden häufig von den Supermärkten zurückgenommen (haltet die Augen nach der Entsorgungswand innerhalb des Marktes offen!). Wenn ihr eine der Sammelstellen für Getränkekartons in eurer Nähe habt, könnt ihr eure Tetrapaks auch dorthin bringen. Und neu führt auch die Migros – eine der beiden grössten Supermarktketten – eine Gemischtsammlung für rezyklierbare Kunststoffe ein.
Was bringt euch der ganze Aufwand? Nicht nur ein reines Gewissen: Was immer ihr an diesen für euch kostenfreien Sammelstellen entsorgt, landet nicht im Hauskehricht (Restmüll), für den hierzulande deftige Gebühren pro Abfallsack zu entrichten sind. Bedingung für ein effektives Recycling ist allerdings, dass nur die gewünschten Abfälle in den jeweiligen Sammelstellen landen!
Warum gibt es keine zentrale Gemischtsammlung in der Schweiz?
Das Recycling aus einer Gemischtsammlung liefere eine verminderte Ausbeute und Qualität, sagen die Recyclingverantwortlichen in der Schweiz. Laut einem Beitrag des Verbrauchermagazins „Kassensturz“ beim Schweizer Fernsehen (Moderation und Interviews in Mundart, Kommentar in Hochdeutsch) liege die Ausbeute oft unterhalb dessen, was private Anbieter einer Gemischtsammlung behaupten. Ausserdem ist die nachträgliche Sortiererei teuer. So teuer, dass das Geld sinnvoller für die Umwelt eingesetzt werden könne. Viele private Anbieter von Gemischtsammlungen in der Schweiz verkaufen deshalb die gesammelten Abfälle in die Nachbarländer – und können dann nicht mehr kontrollieren, was damit geschieht.
Das Paretoprinzip und die Müllvermeidung
Das lässt mich persönlich an das Paretoprinzip denken: Wenn 100% aller Bemühungen 100% der Ergebnisse bringen, seien demnach nur 20% der Bemühungen nötig, um 80% der Ergebnisse zu erzielen (und umgekehrt brächten die übrigen 80% der Bemühungen nur 20% der Ergebnisse. Ob die Zahlenverhältnisse genau so überall anwendbar sind, sei dahingestellt. Kern der Sache ist in meinen Augen, dass Perfektionismus unglaubliche Ressourcen verschlingen und dabei vergleichsweise wenig bringen kann.
Das ist besonders dann spannend, wenn man mit begrenzten Ressourcen zurechtkommen muss. Wie auch im Umweltschutz: Wie in vielen Bereichen ist die begrenzteste Ressource hier wohl das Geld. Und das mag an anderer Stelle (sei es zum Ausbau funktionierender Kreisläufe, zur Förderung der Verwendung rezyklierbarer oder zur Entwicklung völlig neuer Materialien) effektiver eingesetzt werden können, als zum Aussondern weniger wiederverwertbarer Stoffe aus einem grossen Rest, der am Ende in der Müllverbrennungsanlage landet.
Der Kassensturz-Beitrag kommt für den Kunststoffsammelsack der Migros (bislang nur im Raum Luzern erhältlich) noch zum besten Testergebnis: Der „orange Riese“ sammelt nur ausgewählte Kunststoffe und lässt tatsächlich recyceln – noch dazu in einer Anlage in der Schweiz. Ich bin gespannt, ob das auch funktioniert, wenn die Sammlung bis zum Frühling 2021 auf das ganze Land ausgeweitet wird.
Grundsätzlich gilt: Je ausgewähltere und sauberere Abfälle ein Anbieter sammelt, desto besser ist die zu erwartende Ausbeute. Wenn ihr Säcke für die Sammlung gemischter Kunststoffe verwendet, beachtet daher unbedingt die Gebrauchsanweisung!
Wirklich effektiv gegen Plastikmüll geht so
Hier folge ich meinem persönlichen Paretoprinzip: Mit überschaubarem Aufwand möglichst viel erreichen! Klar sollte man nach Möglichkeit keinen Abfall produzieren. Aber nicht jeder hat einen Unverpackt-Laden in seiner Nähe, und eine weite Anfahrt kostet nicht nur Zeit und Geld, sondern auch Kraftstoff in irgendeiner Form, der wieder zu Lasten der Umwelt geht.
Sehr einfach sind aber folgende Massnahmen:
- Verwendet Mehrweg-Einkaufssäcke /- behälter – nicht nur im Supermarkt, sondern auch im Kaufhaus und anderen Geschäften
- Nutzt die Mehrweg-Gemüse-Netzbeutel, die hier in der Schweiz in beiden Grossverteiler-Ketten angeboten werden (gibt es die in D und Ö auch? Falls nicht, sind die ein tolles Andenken an euren nächsten Schweiz-Urlaub 😉 )
- Achtet, wenn ihr Produkte in Kunststoff-Verpackungen, insbesondere Flaschen, kauft, auf ein rezyklierbares Design. Das könnt ihr an folgenden Eigenschaften (gemäss den Richtlinien für Verpackungs-Hersteller) erkennen:
- Das Material: Das Recyclings-Symbol mit der Ziffer im Pfeil-Dreieck, oft auf dem Flaschenboden, verrät es euch: PE (Ziffer 02 bzw. 04), PP (Ziffer 05) oder PET (Ziffer 01) sind leicht wiederverwertbar.
- Die Farbe: PE und PP sind von Natur aus matt weiss und undurchsichtig. PET ist dagegen von Natur aus durchsichtig. Oberflächeneffekte wie Fluoreszenz („grelle“ Farben!) oder „metallic“-Schimmer entstehen durch Zusatzstoffe und verhindern die Wiederverwertung!
- Etiketten: Sollten nicht mehr als 80% (vier Fünftel) der Flaschenoberfläche bedecken.
- Vermeidet Produkte, die übermässig verpackt sind. Ein Klassiker ist unnötig vorgeschnittenes Obst: Die meisten Früchte sind von Natur aus mit einer Schale ausgestattet, die besten Schutz vor äusseren Einflüssen bietet. Die braucht ihr nur selber aufzuschneiden.
- Kauft Getränke in Mehrweg- oder PET-Flaschen (letztere insbesondere, wenn ihr in der Schweiz seid) und entsorgt sie wie vom Anbieter vorgesehen.
- Achtet beim Kauf von Kunststoff-Gegenständen auf gute Qualität und nutzt sie lange bzw. „vererbt“ sie weiter, wenn ihr sie nicht mehr braucht.
- Versucht euch im Upcycling: Viele gebrauchte Kunststoff-Verpackungen und -gegenstände könnt ihr auf neue Art verwenden oder geben prima Bastelmaterial ab – oder Rohstoffe zum Experimentieren!
Was haltet ihr von den Recycling-Bestrebungen in eurem Land? Habt ihr noch mehr Ideen zur Vermeidung von Kunststoff-Abfällen? Wie geht ihr mit euren Abfällen um?