Le Châtelier und die Ferienflieger – ein chemisches Gleichgewicht auf dem Flughafen
Wie erklärt man das chemische Gleichgewicht? Wie stellt man die spannenden Vorgänge, die sich in abstrakten Konzepten und Reaktionsgleichungen verbergen, anschaulich dar?
Was geschieht in einem System im Gleichgewicht? Und wie kann dieses Geschehen beeinflusst werden?
Diese Fragen haben mich lange verfolgt, und die Antworten fanden sich, wie so oft, unerwartet.
Eine unverhoffte Begegnung mit einem Experten
Wieder einmal viel zu früh am Flughafen beginne ich meine Ferien damit, auf dem Aussichtsdeck über diesen Artikel nachzusinnen. Dabei fällt mir ein Herr ins Auge, der in einem geradezu skurril altmodischen Anzug an der Brüstung lehnt und wie gebannt das Treiben auf dem Rollfeld beobachtet. So fehl am Platze er dort wirkt, so sehr zieht seine Erscheinung mich an. Ehe ich mich versehe, bin ich neben ihn getreten.
„Oh, bonjour, Madame! Ich sah Sie gar nicht kommen. Aber leisten Sie mir doch an diesem spannenden Ort Gesellschaft.“
Ich erwidere den Gruss mit einem verlegenen Lächeln, und schon fährt der freundliche Herr mit seinem eindeutig französischen Akzent fort: „Was führt Sie an diesen überaus spannenden Ort?“
„Ich bin auf dem Weg in die Ferien“, erkläre ich, „einmal den ständigen Gedanken um die Arbeit entkommen.“
Sogleich sehen mich neugierige Augen durch einen antiquierten Zwicker forschend an. „Arbeit klingt interessant. Was tun Sie denn?“
„Ich schreibe einen Blog. Geschichten um Themen aus der Chemie und den anderen Naturwissenschaften. Und ich plane einen Artikel über das Chemische Gleichgewicht. Nur, mir fällt nichts rechtes dazu ein…“
Kaum habe ich die Chemie erwähnt, spreizt der buschige Schnauz meines Gegenübers sich zu einem breiten Lächeln, welches sein bislang so ernstes Gesicht strahlen lässt.
„Mon Dieu! Was eine perfekte Fügung! Ich selbst bin Chemiker, und noch dazu Experte auf dem Gebiet des chemischen Gleichgewichts. Darf ich mich vorstellen? Mein Name ist Le Châtelier.“
„Henry Louis Le Châtelier?“ Ich runzle verwirrt die Stirn. „Aber…“
„Oui, das ist korrekt. Und sparen Sie sich die Bemerkung, dass ich seit 1936 tot sein müsste. Das Leben ist dafür einfach zu spannend. Ausserdem bin ich doch zur rechten Zeit am richtigen Ort, oder nicht?“
Ich nicke perplex. „In der Tat. Es wäre mir eine Ehre, von Ihnen über das chemische Gleichgewicht zu hören.“
Le Châtelier lächelt erneut und wendet sich dem Treiben unter uns zu. „Ein Gleichgewicht können Sie einfacher finden, als Sie denken, nicht nur, wenn es um chemische Reaktionen geht. Über die chemische Reaktion haben Sie schon geschrieben?“
Ich nicke. Und denke daran, wie 5 wichtigste Typen chemischer Reaktionen auf einer Grillparty zusammenfanden.
Eine umkehrbare chemische Reaktion auf dem Rollfeld
„Dann wissen Sie ja, was geschieht, wenn zwei Stoffe miteinander reagieren: Die Moleküle der beiden Stoffe treffen aufeinander und ihre Atome werden zu neuen Molekülen neuer Stoffe umgebaut. Das gleiche geschieht hier auf dem Flughafen.“
Der seltsame Franzose deutet weit ausholend auf das Rollfeld hinab.
„Hier besteht ein Stoff, der ‚Fuhrpark‘ heissen soll, aus leeren Flugzeugen, die die Moleküle des Fuhrparks sind. Ausserdem gibt es hier einen Stoff, der ‚Kundschaft‘ heissen soll und aus Passagieren besteht, die die Moleküle der Kundschaft sind. Und dort, an den Gates, treffen diese beiden Stoffe aufeinander und reagieren zu einem neuen Stoff namens ‚Ferienflieger‘, dessen Moleküle besetzte Flugzeuge sind.“
 „Und dort drüben steigen gerade Passagiere aus einem besetzten Flugzeug wieder aus“, werfe ich ein.
„Und dort drüben steigen gerade Passagiere aus einem besetzten Flugzeug wieder aus“, werfe ich ein.
„Richtig“, kommentiert Le Châtelier, „da läuft die Reaktion in die entgegengesetzte Richtung ab.“
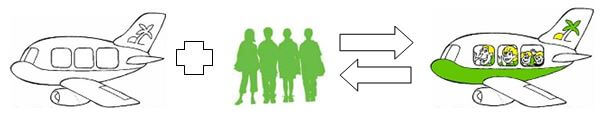
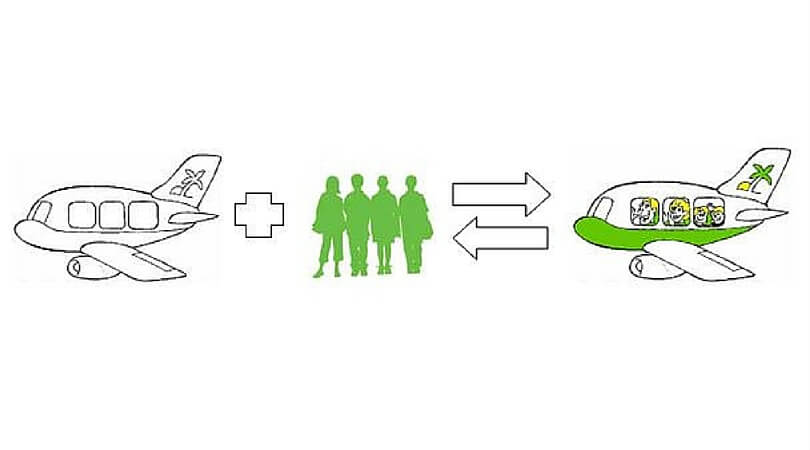
 „Und beides geschieht bei denselben Bedingungen im Flughafenbetrieb. Diese Reaktion läuft also zur gleichen Zeit in beide Richtungen.“
„Und beides geschieht bei denselben Bedingungen im Flughafenbetrieb. Diese Reaktion läuft also zur gleichen Zeit in beide Richtungen.“
 2 Richtungen, eine Geschwindigkeit: Der Flughafen im Gleichgewicht
2 Richtungen, eine Geschwindigkeit: Der Flughafen im Gleichgewicht
Wir beobachten das Treiben einige Zeit schweigend. An einem Gate steigen Passagiere in ein Flugzeug, an einem anderen Gate steigen sie wieder aus. Nach einer Weile sieht Le Châtelier mich herausfordernd schmunzelnd an:
„Und, Madame, fällt Ihnen etwas auf?“
„Hm…es scheint mir, als würden weder die Gates noch das Rollfeld voller oder leerer, obwohl ständig ein- und ausgestiegen wird. Es sind stets gleich viele Flugzeuge auf dem Rollfeld, besetzte wie leere, und gleich viele Passagiere an den Gates unterwegs.“
„Wunderbar beobachtet!“, ruft der Franzose entzückt aus, „Das ist das Geheimnis des Gleichgewichts! Wir sehen, dass unsere entgegengesetzten Reaktionen ständig ablaufen, aber die Menge der daran beteiligten Stoffe bleibt immer gleich.“
Einen Augenblick bin ich verwirrt, dann ereilt mich ein Geistesblitz. „Das ist aber nur unter einer Bedingung möglich: Nämlich dann, wenn beide Reaktionen gleich schnell ablaufen“, erwidere ich, von Le Châteliers Begeisterung angesteckt.
„So ist es“, gibt er denn gleich zurück, „In der Zeit, in welcher 135 Passagiere einsteigen, steigen irgendwo anders auch 135 Passagiere wieder aus. Das Ein- und das Aussteigen laufen mit der gleichen Geschwindigkeit ab. Die Abfertigung läuft, aber am Gedränge auf dem Flughafen ändert sich nichts. Der Flughafen befindet sich somit im Gleichgewicht. Den Betreiber wird das freuen.“
„Zumal der Betreiber seinen Flughafen kennt und daher weiss, bei welchem Verhältnis der Stoffmengen zueinander sich das Gleichgewicht jeden Tag einstellen wird – wenn Ihr Modell wirklich stimmt.“
„Natürlich stimmt mein Modell. Und Sie haben ganz recht: Wenn der Flughafen sich im Gleichgewicht befindet, hat das Verhältnis von Passagieren und leeren Flugzeugen zu den besetzten Flugzeugen seinen ganz eigenen und immer gleichen Wert. Und das unter – zumindest nahezu – allen Umständen.“
„Der Wert des Verhältnisses der Stoffmengen zueinander ist also eine unverkennbare und unveränderliche Eigenschaft eines chemischen Gleichgewichts.“
Das chemische Gleichgewicht ist ein dynamisches Gleichgewicht
Le Châtelier nickt, als mir plötzlich ein Gedanke kommt. „Weshalb wird solch ein Gleichgewicht dann eigentlich auch dynamisches Gleichgewicht genannt?“
„Nun“, antwortet er, „weil das chemische Gleichgewicht alles andere als starr und unveränderbar ist. Verschiedene Umstände bestimmen, in welchen Mengen die beteiligten Stoffe vorhanden sind, während ein System wie unser Flughafen sich im Gleichgewicht befindet. Ändern sich diese Umstände, so ändern sich auch die Stoffmengen auf einen neuen Wert. Einzig das Verhältnis dieser Stoffmengen zueinander bleibt dabei gleich.“
„Und welche Umstände sind das?“
„Von Bedeutung sind vor allem die drei folgenden. Passen Sie auf!“
Einfluss der eingesetzten Stoffmenge auf das Gleichgewicht
Der Franzose zieht eine Taschenuhr aus seinem altmodischen Anzug und wirft einen prüfenden Blick darauf. „Bislang ist hier verhältnismässig wenig Kundschaft unterwegs. Die wenigen Passagiere, die durch den Abflugbereich streifen, versammeln sich hier und da an den Gates und steigen in ein Flugzeug. Viele Maschinen stehen jedoch leer an der Gangway. Aber die Stosszeit beginnt gerade erst. Sehen Sie nur!“
Ich spähe hinab in den Wartebereich vor den Gates, und tatsächlich: Aus den Eingeweiden des Flughafens strömen nun scharenweise Menschen und ergiessen sich in die langen Gänge zwischen den Gates. Beim Bodenpersonal wird emsige Betriebsamkeit erkennbar, als die Passagiere sich an den Zugängen sammeln und an Bord gelassen werden. So füllt sich ein Flugzeug nach dem anderen, und schon Minuten später rollen deutlich mehr besetzte Flugzeuge zur Startbahn als zuvor.
„Sie sehen“, erklärt Le Châtelier, „eine Erhöhung der Stoffmenge der Kundschaft hat dazu geführt, dass in den letzten Minuten mehr Passagiere einsteigen, also reagieren konnten, als in der gleichen Zeitspanne zuvor. So hat auch die Stoffmenge der besetzten Flugzeuge zugenommen.“
„Wenn man also die Stoffmenge eines der Ausgangsstoffe einer Reaktion im Gleichgewicht erhöht, verschiebt sich das Verhältnis der Stoffmengen in Richtung des Reaktionsprodukts.“
„Richtig! Die Lage des Gleichgewichts verschiebt sich in Richtung der durch die Stoffmengenerhöhung angekurbelten Reaktion.“
„Das heisst, wenn hier plötzlich mehr besetzte Flugzeuge landen und an die Gates rollen, werden wiederum mehr Passagiere in die Gänge strömen und mehr leere Flugzeuge zurückbleiben.“
„So ist es. Und sobald die Stosszeit vorbei ist und weniger Maschinen landen, verschiebt sich die Lage des Gleichgewichts auch wieder in die andere Richtung. Im Augenblick jedoch hat es sich den Umständen der Stosszeit entsprechend neu eingestellt.“
Tatsächlich erscheint die Anzahl der Passagiere an den Gates und der Flugzeuge auf dem Rollfeld nun wieder gleich bleibend, auch wenn sichtlich mehr Maschinen besetzt und die Gates von sichtlich mehr Passagieren belebt sind als vor der Stosszeit. So erkenne ich auch, dass das Verhältnis von den Passagieren zu den besetzten Flugzeugen das gleiche ist wie vor der Stosszeit am weniger belebten Flughafen.
Einfluss des Volumens auf das Gleichgewicht
Ich möchte gerade eine entsprechende Bemerkung machen, als plötzlich eine laute Durchsage ertönt: „Achtung an alle! Aufgrund einer technischen Störung wird Terminal E vorübergehend geschlossen! Alle Flüge von Terminal E werden bis auf weiteres an den Terminals A bis D abgefertigt! Weitere Informationen entnehmen Sie bitte den Abflug-Bildschirmen!“
„Technische Störung…“, entfährt es mir, „wohl eher ein Bombenalarm… Aber wie wollen die den ganzen Andrang jetzt bewältigen?“
„Schauen Sie nur“, meint Le Châtelier schmunzelnd, „das Personal an den Gates wird bereits ganz hektisch.“
Wir beobachten gespannt, wie das Gedränge in den noch offenen Terminals immer dichter wird, während die wartenden leeren Flugzeuge in fiebriger Eile abgefertigt werden. Gleichzeitig stauen sich die gelandeten Maschinen auf dem Rollfeld.
„Und wieder verschiebt sich die Lage des Gleichgewichts zu den besetzten Flugzeugen hin – und weg von dem ganzen Gedränge an den Gates.“
„Oui“, bestätigt der Franzose neben mir. „Der Vergleich funktioniert hier aber nur, weil sich die Menschen ihres Jahrhunderts wie Moleküle eines Gases verhalten. Haben sie Platz, verteilen sie sich weitest möglich, und engt man sie ein, rücken sie widerwillig näher zusammen. Wenn sie aber erst mit einem leeren Flugzeug zu einem besetzten Flugzeug reagiert haben, sind sie am Platz sparendsten untergebracht.“
„Das Volumen eines Systems hat also nur dann Einfluss auf die Lage des chemischen Gleichgewichts, wenn wenigstens ein Gas daran beteiligt ist.“
„Und wenn auf einer Seite der Gleichgewichtsgleichung die Anzahl aller Gasmoleküle kleiner ist als auf der anderen. Denn nur dann hilft eine Verschiebung beim Platz sparen.“
Einfluss von Wärme auf das Gleichgewicht
„Dann fehlt jetzt nur noch ein einflussreicher Umstand“, bemerke ich, als sich das Gleichgewicht auf dem Flughafen wiederum neu eingestellt hat.
Le Châtelier nickt. „Und wie es der Zufall will habe ich erfahren, dass der CEO des Flughafenbetreibers heute zur Inspektion seines Betriebs erwartet wird – und zwar in wenigen Minuten. Da wird dort jeder ganz besonders eifrig arbeiten.“
„Es wird also mächtig heiss hergehen“, stelle ich grinsend fest.
„Und ob“, pflichtet mein französischer Begleiter mir bei. „Aber sehen Sie nur, was mit dem Gleichgewicht geschieht!“
Wir beobachten, wie von einer Minute auf die andere der Arbeitseifer des Bodenpersonals zunimmt, als der grosse Boss im Terminal angekündigt wird. Und da Eifer ansteckend wirkt, bewegen sich auch die Passagiere merklich zügiger, stellen sich in Reihen auf und besteigen ein leeres Flugzeug nach dem anderen.
„Es ist gar nicht so einfach, all die Passagiere richtig geordnet in das Flugzeug zu sortieren“, kommentiert Le Châtelier. „Das weiss jeder, der selbst schon einmal mitgeflogen ist. Es verlangt einiges an schweisstreibender Arbeit.“
„Demnach ist die Reaktion der Passagiere mit den leeren Flugzeugen zu besetzten Flugzeugen endotherm, sie ‚verbraucht‘ Energie!“
„Richtig. Und Wärme ist eine Form von Energie.“
„Sobald also die Anwesenheit des CEOs die Wärme im System erhöht, befeuert das die endotherme Reaktion…“
„…und die Lage des Gleichgewichts verschiebt sich auf die Seite mit den energiereicheren Molekülen, hier also den besetzten Flugzeugen.“ Le Châtelier lächelt wissend. „Sobald der CEO seiner Wege geht und die Wärme abnimmt, wird das Aussteigen umso flüssiger gehen. Das tun die Passagiere nämlich wie von selbst und geben ihre mitgebrachte Energie bereitwillig an den Flughafen ab.“
„Die Reaktion der besetzten Flugzeuge zu leeren Flugzeugen und Passagieren ist also exotherm. Und eine Abnahme der Wärme im System verschiebt die Lage des Gleichgewichts auf die Seite mit den energieärmeren Molekülen. So werden sowohl erhitzte Gemüter als auch eine frostige Stimmung vermieden: Durch die Verschiebung hält sich die Temperaturänderung im System in Grenzen.“
Der Franzose wirkt sehr zufrieden mit mir, als er wiederum nickt.
Das Prinzip von Le Châtelier
Ich atme tief durch. „So viele Umstände, Einflüsse und Verschiebungen. Wie soll man sich das nur merken?“
„Dafür habe ich doch mein Prinzip“, erwidert Le Châtelier lächelnd, „das Prinzip des kleinsten Zwanges: Übt man auf ein System im chemischen Gleichgewicht einen Zwang aus, so verschiebt sich die Lage des Gleichgewichts derart, dass der Zwang gemildert wird!“
„Ganz gleich also, ob die Stosszeit anfängt, es einen Bombenalarm gibt oder der Chef zu Besuch kommt, das Flughafen-Gleichgewicht verschiebt sich so, dass die Folgen des jeweiligen Ereignisses gemildert werden.“
„Und das gilt ebenso für jedes chemische Gleichgewicht. Fällt Ihnen eines ein?“
Mein chemisches Gleichgewicht
„Natürlich!“, gebe ich zurück. „Eines, das jeder kennt: In sprudelndem Mineralwasser ist Kohlensäure, H2CO3, enthalten, die laufend zu dem Gas Kohlendioxid, CO2, und Wasser, H2O, reagiert, während Wasser und Kohlendioxid zu neuer Kohlensäure reagieren. Die Kohlensäure befindet sich also im Gleichgewicht mit Kohlendioxid und Wasser.
Und so lange die Wasserflasche geschlossen ist, liegt das Gleichgewicht auf der Seite der Kohlensäure. Wenn Sie die Flasche jedoch öffnen, wird das Volumen, welches das Kohlendioxid-Gas einnehmen kann, plötzlich sehr viel grösser. Sie können dann sehen, wie sich das Gleichgewicht verschiebt: Die Kohlensäure reagiert dem Platzangebot folgend rasch zu Wasser und Kohlendioxid, das in kleinen Gasperlen aus dem Mineralwasser sprudelt, bis sich das Gleichgewicht wieder eingestellt hat.“
„Oh, oui“, meint Le Châtelier, „und dieses Gleichgewicht liegt ohne den Zwang eines sehr kleinen Volumens sehr weit auf der Seite des Kohlendioxids. Wenn man die Flasche nicht ganz schnell wieder zu macht, schmeckt das Wasser ohne Kohlensäure bald furchtbar schal.“
Fazit
Ich nicke wissend und fasse noch einmal zusammen: „Ein chemisches Gleichgewicht hat sich dann eingestellt, wenn zwei Reaktionen, die einander ungehindert umkehren, stetig und gleich schnell ablaufen. Wie das Ein- und Aussteigen der Passagiere am Flughafen. Denn so bleiben die Stoffmengen der daran beteiligten Stoffe trotz laufender Reaktionen gleich.
Ein solches Gleichgewicht ist dynamisch, kann also durch Veränderung der äusseren Umstände verschoben werden. Dabei folgt es dem Prinzip des kleinsten Zwanges: Wenn die Veränderung der äusseren Umstände einen Zwang bedeutet, verschiebt sich das Gleichgewicht so, dass die Folgen dieses Zwanges gemildert werden.
Nun muss ich das Ganze nur noch zu eine Blog-Artikel zusammenbringen…Was meinen Sie, Monsieur…?“
Doch als ich mich umsehe ist der Herr im altmodischen Anzug spurlos verschwunden. Unser Gespräch über das chemische Gleichgewicht ist mir seither jedoch völlig klar im Gedächtnis geblieben.
Und kannst du das Prinzip von Le Châtelier nun auf dein chemisches Gleichgewicht anwenden?
Bildnachweis:Gleichungen: Gruppen von Menschen from Clipart.me



















Hallo,
Tolle Seite hast du hier erstellt! Eine Frage zu dem Artikel hier: Warum reagiert die Kohlensäure und das Wasser bei der geschlossenen Flasche immer weiter miteinander und umgekehrt? Warum bleibt die Kohlensäure nicht einfach Kohlensäure und Wasser einfach Wasser? Wozu ‚das ständige ein- und aussteigen‘?
Vielen Dank für das Lob!
Moleküle wie die von Wasser und Kohlensäure sind (bei Temperaturen über dem absoluten Nullpunkt) ständig in Bewegung – auch in geschlossenen Flaschen. Die Bewegung ist eine Erscheinungsform von Energie, die sich in der Temperatur des Stoffes wiederspiegelt.
Dabei rempeln sie sich ständig an. Und sie sich im richtigen Winkel mit ausreichender Wucht rempeln, können sie neue Bindungen bilden und dafür alte lösen: Sie reagieren miteinander (wie z.B. Wasser und Kohlenstoffdioxid). Oder die ebenfalls ständig stattfindende Bewegung innerhalb eines Moleküls endet damit, dass ein Molekül schlicht auseinanderfällt (wie z.B. Kohlensäure in Wasser und Kohlenstoffdioxid). In der geschlossenen Flasche sind die Verhältnisse gerade so, dass stets ebenso viele passende Rempler wie auseinanderfallende Moleküle vorkommen.