Morgen kommt der Weihnachtsmann….Okay. Eigentlich ist es erst in 18 Tagen soweit. Aber heute, am 6. Dezember, ist mir der Nikolaus – oder Samichlaus (oder doch der Weihnachtsmann?) – schon über den Weg gelaufen…in ungewöhnlich kleiner Gestalt:
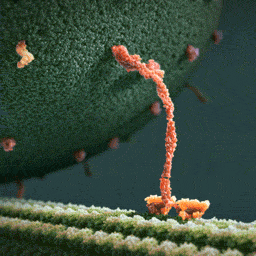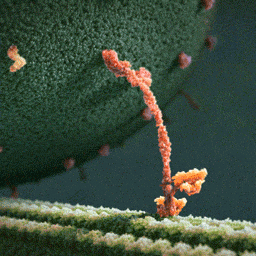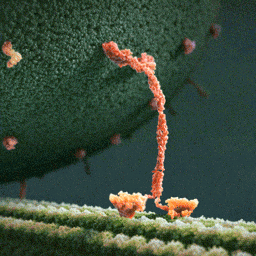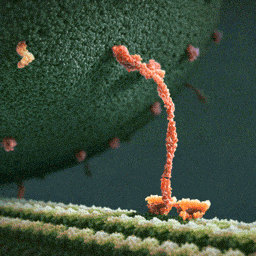
Da spaziert doch tatsächlich ein Molekül(!) in aller Ruhe einen mikroskopischen Schlauch entlang – und schleppt einen Riesensack voller Geschenke hinter sich her! Und die Diskussionen, worum es sich bei diesem Weihnachtsmann a miniature wirklich handelt, schlagen im weltweiten Netz hohe Wellen.

Das Thema des Tages ist, wie sollte es anders sein, „Nikolaus“.
Weitere Beiträge zum Tagesthema findet ihr hier:
http://cosmic-blue.jimdofree.com
http://imaginary-lights.net
In mir hat der Anblick des molekularen Weihnachtsmanns (und ich konnte mich kaum mehr davon losreissen) vor allem wachgerufen, weshalb ich im Laufe meiner Studienzeit der Biochemie verfallen bin: Die vielfältigen und zuweilen schier unglaublichen Funktionsmöglichkeiten von Biomolekülen sind einfach atemberaubend. Beflügelt von solchen Erinnerungen war dieser kleine Weihnachtsmann nach einem eingehenden Blick ins Biochemie-Buch [1] auch schnell identifiziert:
Die Identität des molekularen Weihnachtsmanns
Bei dem spazierenden lachsfarbenen Gebilde handelt es sich um ein sogenanntes Motorprotein namens Kinesin, also eine lange Kette aneinander gebundener Aminosäuren, die zu einer ganz bestimmten Form zusammengelegt, -gezwirbelt und -geknäuelt ist – etwa wie ein Luftballon-Tier, das aus einem schlauchförmigen Ballon geknotet wird. Streng genommen besteht das Kinesin sogar aus zwei solcher Ketten, die miteinander verdrillt sind (wenn man den langen, aufrechten Schaft genau ansieht, kann man die zwei Stränge einer Doppelspirale erkennen).
Ein Kinesin-Molekül ist natürlich nicht lachsfarben. Vielmehr zeigt die Animation ein Modell, das sich bestmöglich von seinem grünen Hintergrund abheben soll. Die Gestalter der Animation haben die Farben also bewusst komplementär gewählt…und dabei zufällig eine weihnachtliche Ader bewiesen.
Die hellgrüne „Strasse“, die das Kinesin entlangschreitet, ist ein Mikrotubulus, eine aus zahllosen Exemplaren des Proteins Tubulin zusammengesetzte molekulare Röhre. Die einzelnen rundlichen Tubuline, die sich wie Pflastersteine aneinanderreihen, sind in der Animation gut zu erkennen. Das Kinesin und seine Mikrotubulus-Strasse sind so geschaffen, dass dieses Motor-Protein nur vom Zellinneren in Richtung Zell-Aussenhaut laufen kann.
Nur so kann sich Kinesin nämlich als anständiger Weihnachtsmann betätigen: Es transportiert seinen Sack voller Geschenke, die in den Organellen im Zellinneren hergestellt worden sind, stets zur äusseren Zellmembran, wo sie hinausgeschafft und auf ihre weitere Reise zu ihren hoch erfreuten Empfängern geschickt werden können.
Der Geschenke-Sack wird in dieser Animation als grosse Kugel aus wogenden, dunkelgrünen Stoppeln dargestellt. Es handelt sich um eine geschlossene Blase (die Zellbiologen sagen Vesikel) aus Zellmembran, die sich ihrerseits aus unzähligen Molekülen, den Membranlipiden, zusammensetzt. Jedes dunkelgrüne Härchen ist ein solches längliches Lipid-Molekül. Und wie es sich für eine anständige Zellmembran gehört, stecken zwischen all den Lipiden ab und zu lachsfarben dargestellte Membran-Proteine, die der Membran zur Durchlässigkeit für Nährstoffe und Signale verleihen.
Das eigentlich faszinierende an dieser Darstellung ist in meinen jedoch das ständige Wogen der Moleküle. Denn anders als all die starren Zeichnungen in Biologie- und Biochemie-Büchern vermuten lassen, ist eine Zellmembran alles andere als ein starres Gebilde. Stattdessen sind ihre Bausteine ständig in Bewegung, was die Bestandteile einer Zelle zu einer ziemlich dynamischen, geradezu fliessenden Gemeinschaft macht.
Dass der gewaltige, mit Molekülen vollgepackte Sack irgendwie hinter dem Kinesin her zu schweben scheint, ist all den Kleinstmolekülen in seiner Umgebung zu verdanken, die die Animation nicht zeigt. Die meisten dieser Kleinstmoleküle sind Wasser-Moleküle, dazu kommen Ionen und verschiedene allgegenwärtige Verbindungen, die den scheinbar leeren Raum im Bild vollkommen ausfüllen. Was immer sich in der Zelle bewegt, schwimmt praktisch durch ihr Innenleben. Und wer schon einmal im Schwimmbad war weiss, wie sehr der Auftrieb der Schwerkraft entgegenwirken kann.
Wie kann ein Molekül laufen?!
Der Spaziergang des Kinesins auf seinem Mikrotubulus wirkt wohl deshalb so geheimnisvoll, weil die Animation nicht zeigt, wie es seinen Treibstoff erhält. Denn jeder Motor, auch ein molekularer, braucht nunmal seinen Treibstoff, sonst bewegt sich gar nichts. Und der Treibstoff für laufende Moleküle ist chemische Energie, die in lebenden Zellen in dem energiereichen Molekül Adenosintriphosphat (kurz ATP) gespeichert und transportiert wird.
Jeder „Fuss“ des Kinesins hat deshalb eine Bindestelle für ATP. Vor Beginn seiner Arbeit sind an diesen Bindungsstellen „entleerte“ Versionen des ATPs, genannt Adenosindiphosphat (ADP) gebunden. Ein gebundenes ADP sorgt dafür, dass der Fuss eines frei schwimmenden Kinesin-Moleküls, sobald er in die Nähe eines Mikrotubulus‘ gerät, locker daran haften bleibt – ähnlich wie ein Magnetstiefel, mit welchen Star-Trek-Helden bei Schwerelosigkeit über die Aussenhülle ihres Raumschiffes stapfen können. Sobald das geschieht, kann das ADP aus der Bindungsstelle entfernt und durch ein frisches, energiereiches ATP ersetzt werden.
Die Bindung des ATP sorgt für zwei Dinge: Zum Einen wird die Haftung des bereits platzierten Fusses am Mikrotubulus verstärkt. Zum Anderen geht mit dem Austausch von ADP gegen ATP eine Verschiebung der Position der einzelnen Molekülgruppen des Proteins einher. Dies ist möglich, weil einzelne Atomgruppen stets um chemische Bindungen herum gedreht werden können (wer schon einmal ein Molekülmodell zum Zusammenstecken in der Hand hatte: Die Drehbarkeit der Bauelemente um die Bindungsachsen ist in der Regel realistisch!).
Im Fall des Kinesins besteht die Positionsverschiebung darin, dass das zunächst nach vorn abgespreizte Beinchen des Proteins, „neck linker“ genannt, eng an den zugehörigen Fuss angelegt wird. Da der Fuss jedoch fest am Mikrotubulus verankert ist, zieht das Molekül nicht etwa den Fuss zurück, sondern das Molekül wird unweigerlich an den Fuss gezogen. Der zweite, immernoch mit ADP bestückte Fuss wird durch diese Bewegung nach vorn geschleudert und trifft dort, von seinem eigenen neck linker dirigiert, am Mikrotubulus Halt.
Während der zweite Fuss am Mikrotubulus Halt findet, wird das ATP am ersten Fuss gespalten, wobei ADP und ein Phosphat-Anion (das Anion der aus der anorganischen Chemie bekannten Phosporsäure, oft mit dem Kürzel Pa oder Pi (für „anorganisch“ bzw. „inorganic“) bezeichnet) entstehen. Mit der Abgabe des Phosphat-Anions löst sich der erste Fuss samt ADP vom Mikrotubulus, während das ADP im zweiten Fuss gegen ATP ausgetauscht wird, welches dessen Bindung festigt und den nächsten Schritt antreibt.
Eine schematische Animation dieser Schrittfolge mitsamt dem dafür nötigen Treibstoff gibt es als Beiwerk zu einem grossen Lehrbuch über Zellbiologie [2]:
Die Koordination der beiden Haft-Füsse ist dabei präzise genug, dass ein Kinesin-Molekül im Mittel etwa 100 Schritte schafft, bevor beide Füsse einmal gleichzeitig die Bodenhaftung verlieren und das Protein samt seiner Last von seinem Mikrotubulus abdriften kann.
Wie schnell läuft dieser Weihnachtsmann?
Entsprechend seiner Dimensionen – der kleine Weihnachtsmann misst wie er da läuft etwa 50 Nanometer (Milliardstel Meter!) an Höhe [2] – beträgt die Schrittweite des Kinesins im Mittel rund 8 Nanometer[1]. Zum Vergleich: die Wellenlänge von sichtbarem Licht beträgt 390 bis 780 Nanometer, der Durchmesser eines Atoms in einem organischen Molekül wie diesem liegt in der Grössenordnung von 0,1 Nanometern.
Die Physik schreibt vor, dass man Dinge, die kleiner sind als die Wellenlänge des Lichts, auf herkömmliche Weise nicht sehen kann. Trotzdem können Wissenschaftler Kinesin und andere Proteine direkt beobachten. Dazu verwenden sie entweder ein Elektronenmikroskop (die Wellenlänge von Elektronen ist wesentlich kürzer als die des Lichts und kann somit wesentlich kleinere Dinge sichtbar machen!), wofür die Proteine allerdings „eingefroren“ werden müssen, oder sie beobachten den Geschenke-Sack, der sehr viel grösser ist als der eigentliche molekulare Weihnachtsmann.
Mit der zweiten Methode kann man denn auch zuschauen, wie Membran-Säcke oder andere Lasten mit Hilfe von Kinesin einen Mikrotubulus entlang wandern. Eifrige Protokollanten haben dabei festgehalten, dass ein Kinesin-Molekül im Mittel rund 640 Nanometer in der Sekunde ablaufen kann – das entspricht einer Wellenlänge von orangem Licht oder über 6000 Atomen.
Allerdings ist der Schritt des molekularen Weihnachtsmannes längst nicht so stetig und erhaben wie in der Animation dargestellt. Vielmehr gleicht der Gang des Kinesins einem unsteten Schaufensterbummel: Immer wieder bleibt es für willkürliche Zeitspannen stehen oder gerät gar ins Hinken, wenn seine Füsse und „neck linker“ nicht vollkommen symmetrisch gebaut sind. Wenn man die Strecke, die ein Kinesin-Molekül abläuft, also über der dafür benötigten Zeit in ein Diagramm einträgt, erhält man an Stelle einer schönen Gerade, wie die Animation sie vorgibt, einen treppenartigen Kurvenverlauf (in der englischen Ausgabe von Scienceblogs finden sich solche Original-Diagramme in einem detaillierten Beitrag zur Bewegungsgeschwindigkeit des Kinesins ).
Dieser unstete Gang rührt daher, dass für jeden Schritt ein ATP-Molekül mit einem Fuss des Kinesins reagieren muss. Und es obliegt allein der Wahrscheinlichkeitsrechnung, in welchen Zeitabständen eines der ATP-Moleküle, die frei in der Zelle herumschwimmen, direkt am Fuss vorbeikommt und reagieren kann. Wie bei allen chemischen Prozessen können deshalb selbst die fleissigsten Beobachter nur im Mittel angeben, wie schnell eine Reaktion wie der Gang des Kinesins abläuft.
Was für Geschenke bringt der molekulare Weihnachtsmann?
„Sieht so das Glück aus?“ titelt die Süddeutsche Zeitung in ihrem Beitrag zur Animation, in dessen Rahmen der kleine Weihnachtsmann mir auf Facebook erstmals begegnet ist. Der Titel spielt auf Endorphine als möglichen Inhalt des Membran-Sacks an, also molekulare Wohlfühl-Boten, die als körpereigene Opioide auf das Nervensystem wirken. Und zumindest dieser Teil der ursprünglich auf Twitter verbreiteten Bildbeschreibung ist nicht falsch.
Endorphine sind nämlich sogenannte Neuropeptide, das heisst „Miniatur-Proteine“, deren Ketten nur wenige Dutzend Aminosäuren lang sind und als Signalstoffe an Rezeptoren von Nervenzellen binnen können. Solch kleine Peptide sind zu kurz, als dass sie direkt nach ihrer Herstellung direkt mit einem Adress-Schild „nach draussen“ versehen werden könnten. Deshalb werden sie in der Zelle gemeinsam mit anderen Peptiden in einer gemeinsamen, längeren Kette hergestellt, adressiert und in Membran-Blasen verpackt.
Während der Kinesin-Weihnachtsmann seinen vollen Sack der Zell-Aussenmembran entgegenschleppt, können mit im Sack eingesperrte fleissige Weihnachtselfen-Enzyme die langen Protein-Ketten in Endorphine und andere kurze Peptide zerschneiden. Am Ziel angekommen wird der Membran-Sack schliesslich in die Zellmembran eingefügt, wobei der Inhalt ausserhalb der Zelle „ausgekippt“ wird.
Es ist also durchaus möglich, dass der animierte molekulare Weihnachtsmann genau das tut, was ein anständiger Weihnachtsmann tun sollte: Geschenke bringen, die glücklich machen.
Ebenso gut könnte er andere Neurotransmitter oder Hormone durch seine Zelle schleppen, oder Bausteine, die zur Zellteilung benötigt werden, an ihren Bestimmungsort bringen – je nachdem, in welchen Zusammenhang man das Bild einfügt.
Warum handelt es sich tatsächlich um Kinesin?
In dem Animationsvideo, aus welchem das Bild des molekularen Weihnachtsmanns stammt, wird erläutert, dass es sich um ein Motor-Protein handelt, das sich an Mikrotubuli entlang bewegt.
Doch wo es einen Weihnachtsmann gibt, ist auch der Grinch nicht weit. Das gilt auch für das Innenleben menschlicher Zellen. Der zelluläre Grinch ist ebenfalls ein Motor-Protein. Er heisst Dynein und schleppt seine Geschenke-Säcke in die dem Kinesin entgegengesetzte Richtung die Mikrotubuli entlang: Vom Zelläusseren nach innen. Zu erkennen ist dieses Protein an seiner gedrungenen Gestalt ohne den langen „Schaft“ des Kinesins.
Das in dem ursprünglichen Tweet, welcher zum Beitrag in der Süddeutschen Zeitung führte, erwähnte Myosin ist zwar besser als Muskelbestandteil und -motor bekannt, kommt in einer Variante aber auch zum Lastentransport zum Einsatz. Anders als Kinesin und Dynein bewegen sich diese Myosin-Moleküle jedoch an Aktin-Filamenten entlang, feinen Fasern aus dem Protein Aktin. Im Gegensatz zu Mikrotubuli mit einem Aussendurchmesser von 30 Nanometern sind Aktin-Filamente mit nur 5 Nanometern im Durchmesser wesentlich schmaler[1]. Dafür hat das Myosin-Molekül merklich grössere Füsse als Kinesin [2], sodass die Grössenverhältnisse in einer Animation von Myosin auf Aktin deutlich anders ausfallen müssten als beim gezeigten Kinesin auf einem Mikrotubulus, der tatsächlich etwa halb so dick scheint, wie unser Weihnachtsmann hoch ist.
Alle drei Motor-Proteine spielen tragende Rollen in einem Video aus dem Hoogenraad Lab der Universität Utrecht (in Englisch), in welchem ein Kinesin-Molekül namens „John“ seinen molekularen Geschenkesack ganz im Sinne eines guten Modells durch die Strassen von Utrecht schleift. Auf seinem Weg treten auch der „Grinch“ Dynein und Myosin-Moleküle in Erscheinung. Letztere sind für den Last-Transport auf Aktinfilamenten zuständig, die wie Seitengassen von Mikrotubuli abzweigen:
Zum guten Schluss gibt es den Weihnachtsmann noch einmal musikalisch und in grösserem Zusammenhang:
Lasst euch von den Wundern des Lebens verzaubern und denkt an die kleinen Weihnachtsmänner in euren Zellen, wenn ihr die kommenden Feiertage geniesst. Ohne ihre Geschenke würden wir uns längst nicht so wohl fühlen!
Und ist euch der molekulare Weihnachtsmann auch schon begegnet?
Literatur:
[1] J.M. Berg, John L.Tymoczko, L.Stryer: Biochemie. Spektrum Akademischer Verlag GmbH, Heidelberg, Berlin 2003
[2] B.Alberts, A.Johnson, J.Lewis, M.Raff, K.Roberts, P.Walter: Molekularbiologie der Zelle. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2004










