Die Sonne verwöhnt uns an langen, warmen Tagen. Ab und zu sorgen lauer Regen oder wilde Gewitter dafür, dass indes alles grünt und blüht. Der Sommer ist eine tolle Zeit für Experimente im Garten oder auf dem Balkon. In Keinsteins Kiste findet ihr viele spannende Anregungen, wie ihr die Natur um euch erforschen, die Sonnenenergie für Experimente nutzen oder einfach draussen Spass haben könnt. Was macht Blätter grün? Welche buchstäblich coolen Experimente eignen sich für heisse Tage? Oder wollt ihr lieber eine Rakete starten?
In dieser Sammlung von Sommer-Experimenten werdet ihr fündig!
Sicherheit – für euch und euren Garten
Wenn ihr draussen experimentiert, beachtet die gleichen Sicherheits-Grundregeln wie beim Experimentieren drinnen: Sucht euch einen spritz- und allenfalls feuerfesten Experimentierplatz, tragt passende Schutzkleidung (Malschürze wie beim Umgang mit Wasserfarben und bei aggressiven Stoffen Schutzbrille) und esst und trinkt nicht dort, wo ihr experimentiert!
Meine Checkliste zum sicheren Experimentieren findet ihr hier in Keinsteins Kiste zum Download.
Wenn ihr draussen experimentiert, habt ihr zudem einen unbestrittenen Vorteil: Für eine gute Belüftung ist immer gesorgt. Achtet aber darauf, dass eure Nachbarn nicht zu sehr unter stinkenden Experimenten leiden, falls ihr solche durchführt. Oder ladet sie einfach zum Mitforschen ein.
Ganz wichtig ist jedoch: Achtet darauf, dass keine flüssigen oder festen Bestandteile eurer Experimente an die Pflanzen oder in den Boden eures Gartens oder eurer Balkonkübel gelangen!
Das gilt besonders für Säuren und Basen wie Essig oder Natron und Seifen! Die können nämlich nicht nur unsere Haut, sondern auch Pflanzenteile beschädigen. Säuren und Basen können in grösseren Mengen zudem den pH-Wert im Boden so verändern, dass das Leben darin gehörig durcheinander gerät.
Seifen, genauer die Tenside darin, stören den Stoffaustausch zwischen Kleinstlebewesen und dem Wasser in ihrer Umgebung. So können sie für das Leben im Boden sehr gefährlich werden.
Sorgt deshalb für eine schützende Unterlage an eurem Experimentierplatz: Eine Maltischdecke, ein Tablett oder Backblech oder eine Plane auf dem Rasen können euch gute Dienste leisten.
Wenn ihr diese Sicherheitsvorkehrungen beachtet, steht dem Experimentierspass ohne Schaden an euch oder eurem Garten nichts mehr im Wege! Also los:
13 Experimente für draussen
Blätter transportieren Wasser – Ein Kontrollversuch macht es sichtbar

Mit diesem einfachen Experiment könnt ihr nicht nur sichtbar machen, dass Pflanzen trinken und schwitzen – und auf diese Weise Wasser aus dem Boden (oder einer Vase) in die Luft transportieren. Ihr könnt auch die Bedeutung eines Kontrollaufbaus (einer „Blindprobe“ oder auch einer Kontrollgruppe) für die Bewertung von Versuchsergebnissen aufzeigen. Oft zeigt sich das Ergebnis eines Versuch nämlich erst im Vergleich mit einem Aufbau ohne die entscheidende Zutat richtig deutlich. Das macht solche Kontrollversuche zu einem unverzichtbaren Werkzeug für die grossen Forscher! Da ihr im Sommer reichlich Zweige mit grünen Blättern finden könnt, können auch eure kleinen Forscher einen solchen Vergleich durchführen. Die Anleitung dazu findet ihr hier.
Das geheimnisvolle Leben der Pflanzen

Rund um Pflanzen gibt es ohnehin so viel zu entdecken. Wenn ihr ein Mikroskop habt – schon ein einfaches USB-Mikroskop genügt! – könnt ihr euch den spannenden Aufbau von Blättern ansehen. Unterwegs könnt ihr nach Sonnen- und Schattenblättern oder nach Standort-Spezialisten Ausschau halten. Und wusstet ihr, dass ihr eine Pflanze, die nach einem langen heissen Tag die Blätter hängen lässt, nicht gleich aufgeben müsst? Ihr könnt sie ganz einfach wiederbeleben! Eine ganze Sammlung von Tipps und Anleitungen rund um Pflanzen und ihre Blätter findet ihr hier.
Photosynthese erleben

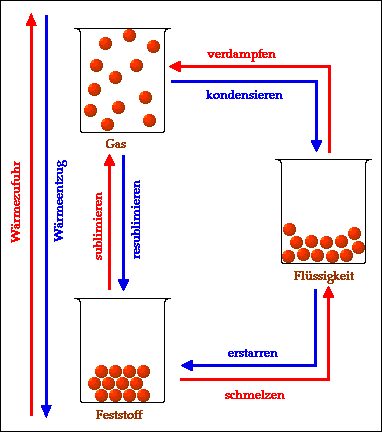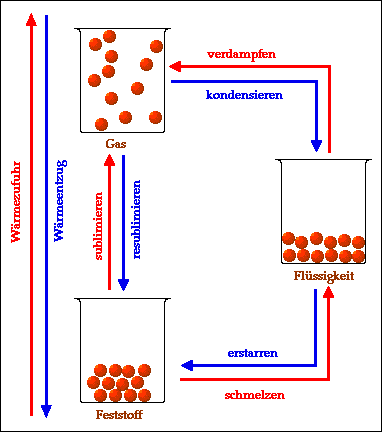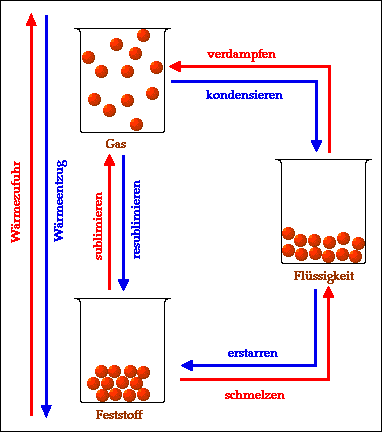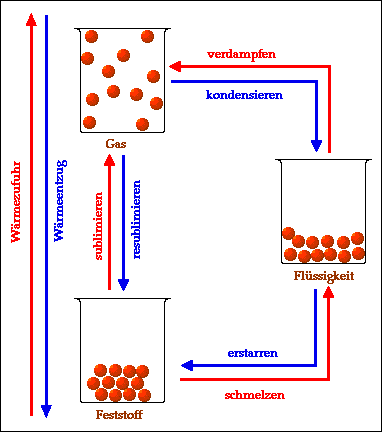
Pflanzen leben von Luft und Licht…und von Wasser natürlich. Weitere Nährstoffe brauchen sie nur in vergleichweise winzigen Mengen. So kommt es, dass die wilden Gewächse, in die sich selbst unsere Topfpflanzen im Zimmer manchmal verwandeln, uns immer wieder zum Staunen bringen. Das Geheimnis dahinter: Pflanzen bauen aus CO2 und Wasser mit Hilfe von Lichtenergie Kohlenhydrate – die Bestandteile ihrer selbst – auf. Dabei entsteht praktischerweise Sauerstoff als Abfall. Den Vorgang, der dahinter steckt, nennen die Biochemiker Photosynthese. Und ihr könnt nicht nur die Entstehung von Sauerstoff, sondern auch die Bildung von Stärke in Pflanzenteilen einfach nachweisen. Wie das geht, erfahrt ihr hier.
Raketenstart mit dem perfekt berechneten Treibstoff

Wer eine Rakete starten möchte, braucht möglichst viel Triebkraft bei möglichst wenig Gewicht. Essig und Natron geben einen prima Treibstoff ab, der für euch weitestgehend ungefährlich ist. Hier erfahrt ihr nicht nur, wie ihr aus Abfällen eure eigene Rakete baut, sondern auch wie ihr das perfekte Gemisch für euren Treibstoff ausrechnen könnt. Stöchiometrie nennen Chemiker diese Art zu rechnen. Wenn ihr eure Startrampe auf dem Rasen errichtet, empfehle ich euch eine Plane darunter zum Schutz des Grüns. Denn der Antrieb dieser Rakete beruht zwar darauf, dass Essig und Natron einander neutralisieren. Aber es hat wohl noch kein Raketen-Experiment gegeben, bei dem nicht einmal irgendetwas schief gelaufen wäre!
Spass mit Elefantenzahnpasta

Womit putzen Elefanten sich die Zähne? Mit einer grossen Menge schaumigem Zeug? Könnte man meinen…aber Scherz beiseite. Diesen Schaum solltet ihr besser nicht anfassen – aber Zuschauen allein macht grossen Spass! Auch für diesen Schaumvulkan ist ein Gasentstehung die Triebkraft. Hier sorgt Hefe, die mit Wasserstoffperoxid fertig zu werden versucht, für seine Entstehung. Und damit es richtig schäumt, gehört ein Schuss Seife dazu. Da weder die noch Wasserstoffperoxid gesund für den Garten sind, rate ich auch hier dringend zu einer Auffangwanne. Damit steht dem grossen Spass nichts mehr im Wege. Wie ihr die Elefantenzahnpasta anrichtet – vielleicht in einer grösseren Ausgabe als meiner? – erfahrt ihr hier.
Hefegärung mit Sonnenenergie

Hefe kann nicht nur blitzschnell Wasserstoffperoxid loswerden, sondern auch, was euren Kuchen zum Aufgehen bringt: Sich ernähren. Die Art und Weise, wie Hefezellen ihre Nahrung „verdauen“, nennt man Gärung. Und dabei entsteht eine richtig grosse Menge CO2. Die kann nicht nur dafür sorgen, dass euer Teig schön fluffig wird, sondern auch einen Luftballon aufblasen. So könnt ihr mit einem solchen die Gärung ganz einfach sichtbar machen! Und da Hefe es gerne lauschig warm hat, liefert die Sommersonne euch die passende Energie dazu. Wie ihr den Versuch macht, erfahrt ihr hier.
Blattfarbstoffe trennen

Wusstet ihr, dass Blätter im Herbst nicht gelb und rot werden, sondern einfach nur nicht länger grün bleiben? Richtig: In einem grünen Blatt sind stets alle seine möglichen Farben enthalten: Grün, Gelb, Rot. Das Grün ist im Sommer bloss derart in der Übermacht, dass es alle anderen Farben überstrahlt. Im Herbst lagern die Pflanzen es jedoch ein, und übrig bleiben Gelb und Rot, bevor ihre Blätter welken und abfallen. Ihr wollt einen Beweis? Mit diesem spannenden Experiment könnt ihr die Farbstoffe aus grünen Blättern trennen und einzeln begutachten! Da ihr dazu Lösungsmittel braucht, ist die gute Belüftung draussen euch dabei ein grosser Vorteil.
Die mysteriöse Pharaoschlange

Dieser faszinierende Partyspass erfordert ein wenig Vorbereitung seitens grosser Forscher – und eine Geheimzutat, die ihr in der Apotheke oder Drogerie kaufen müsst. Welche das ist, verrate ich hier mitsamt der Anleitung und zwei weiteren verblüffenden Experimenten. Das folgende Spektakel lohnt jedoch den Aufwand: Ihr könnt Zucker zum Brennen bringen und beobachten, wie ein mächtiger Aschewurm sich wie von Zauberhand aus dem Sand erhebt und windet! Und wenn ihr das Ganze draussen macht, braucht ihr euch um den Rauchabzug keine grossen Gedanken zu machen. Ein Spass für jede Gartenparty!
Für heisse Tage im Sommer: Herzen schmelzen…

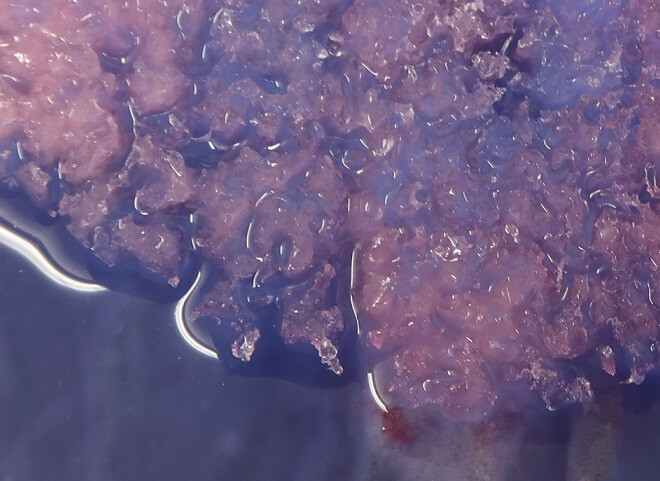
…oder was immer ihr sonst schmelzen lassen wollt. An heissen Tagen sorgt dieses coole Experiment für viel Spass und allfällige Abkühlung. Beobachtet, in welcher Weise Eis schmilzt, beschleunigt den Vorgang mit Salz und erschafft mit bunten Farben surreale Eiswelten. Ganz junge Forscher haben hier ebenso viel Freude wie grössere Kameraleute, die gern farbenfrohe Bilder aufnehmen. Achtet aber darauf, ein Auffangblech oder eine Folie zu verwenden, damit die Farben bleiben, wo sie hingehören und nicht in den Garten laufen! Anleitung und Hintergründe zum Experiment findet ihr hier.
Brausende Herzen schmelzen…mit Essig-Eis

Für diese Variante des Farbenspiels beim Schmelzen macht ihr Eiswürfel nicht aus Wasser, sondern aus Haushaltsessig! In einer Natron- oder Sodalösung zeigen die beim Schmelzen ihren wahrhaft aufbrausenden Charakter. Mit etwas Tinte oder Lebensmittelfarbe wird das Ganze zudem zu einem weiteren Farbspektakel. Aber bitte nicht trinken – auch wenn sie sich neutralisieren sollten, können Essig und Natron auf Schleimhäute ätzend wirken! Auffangblech oder Plane schützen zudem euren Garten, wenn es hoch her geht. Die Anleitung zum Experiment findet ihr hier.
Eis wächst!

Zur Weiterverwendung zwecks Abkühlung an heissen Tagen ist das Eis aus diesem Experiment geeignet. Wusstet ihr, dass Wasser beim Gefrieren wächst? Das ist eine ganz besondere Eigenschaft dieses allgegenwärtigen Stoffes. Forscher nennen sie auch die „Dichteanomalie“ des Wassers: Sie wissen, dass Wasser bei etwa +4°C am „kleinsten“ ist und, wenn es kälter wird, wieder wächst! Auch dann, wenn es beim Kälterwerden gefriert. Deshalb solltet ihr niemals geschlossene Glasflaschen mit Inhalt ins Gefrierfach legen. Denn wenn der Inhalt zu stark wächst, platzen sie! Wie ihr das Wachstum von Eis ganz ohne Gefahr sichtbar machen könnt, erfahrt ihr dagegen hier.
Kinetischer Sand für drinnen und draussen

Ihr habt Sehnsucht nach dem Strand? Der Sandkasten ist öde geworden? Ihr habt gar keinen Platz dafür? Oder der Sommer ist verregnet? Dann habe ich eine gute Nachricht für euch. Mit diesem Rezept könnt ihr kinetischen Sand ganz einfach selber machen! Mit diesem praktischen Sand können kleine Forscher nach Herzenslust bauen und spielen, ohne dass der berüchtigte Strandferien-Effekt eintritt: Sand überall! Denn diese Sandkörner bleiben beieinander, anstatt sich im Wohnraum zu verteilen. So steht dem Spielspass auf der Terrasse oder sogar drinnen nichts mehr im Wege.
Natur-Bingo für den Sommer-Spaziergang am See
Wir haben in diesem besonderen Jahr auf Fernreisen verzichtet und verbringen die Ferien zu Hause. Da gibt es auch so viel zu entdecken! Wenn ihr an einem See oder Teich wohnt oder Urlaub macht, könnt ihr euren Spaziergang durch die Natur dort mit einem spannenden Forscher-Bingo verbinden. Die Anleitung samt Bingokarte zum Ausdrucken findet ihr hier. Wer entdeckt zuerst alle gesuchten Tiere?
Und noch mehr Experimente im Sommer
Viele weitere Versuche in Keinsteins Kiste könnt ihr nicht nur drinnen, sondern ebenso gut auf der Terrasse oder dem Balkon machen. Stöbert und probiert also ruhig nach Herzenslust weiter. Ich wünsche euch viel Spass beim Experimentieren in diesem Forschersommer!
Eure Kathi Keinstein
Und was ist euer Lieblings-Sommer-Experiment? Wenn ihr einen Blog habt oder gerne einmal einen Gastbeitrag schreiben würdet, nehmt damit doch gleich an meiner Jubiläums-Blogparade teil!