Geld verbrennen: Ein Experiment für Leute, die zu viel Geld haben? Keineswegs! Mit diesem chemischen Zaubertrick könnt ihr eure Zuschauer verblüffen (oder sogar erschrecken), ohne dabei arm zu werden!
Viel zu lange war es still in der Kiste – aber keine Sorge, Reto und mir geht es gut. Das ‚erzwungene‘ Innehalten während der COVID-Lockdowns hat mir bloss bewusst gemacht, wie sehr es mich nach einer Pause von allem verlangte. Und dann ergab sich die Möglichkeit, ein Traumprojekt endlich in die Tat umzusetzen!
Zu Keinsteins Kiste gibt es jetzt ein Buch!
Richtig gelesen: Nicht nur viele spannende Experimente aus Keinsteins Kiste, sondern auch zahlreiche neue Versuche und Wissenswertes findet ihr jetzt als „Chemische Spielereien“ im Verlag Wiley VCH Weinheim beim Buchhändler eurer Wahl!
Während der vermeintlichen Stille um die Kiste habe ich euch die spannendsten Experimentieranleitungen und interessante Einblicke in die Chemie eures Alltags auf 150 Seiten stets griffbereit als Hardcover oder E-Book zusammengestellt und freue mich, euch „Chemische Spielereien“ endlich präsentieren zu können.
Und… heisst das nun, dass das Geld ab jetzt in Strömen fliesst, sodass ich ohne Schmerz etwas davon verbrennen kann? Nicht ganz – weshalb ich in diesem Experiment zwar Geldscheine anzünde, aber keinen davon beschädige. Und ihr könnt das auch.
Haltet bei Experimenten mit offenem Feuer stets die Sicherheitsregeln zur Vermeidung von Bränden und Verletzungen ein! Kurz heisst das: Habt einen feuerfesten Experimentierplatz, tragt schwer entflammbare Kleidung, haltet leichtendzündliche Chemikalien von Zündquellen fern und habt bestenfalls ein passendes Löschmittel griffbereit!
Ihr braucht dazu
- Geldschein, beliebiger Nennwert (z.B. Euro oder Schweizer Franken)
- Tiefe Schale oder ähnlichen Behälter
- Grosse Pinzette oder Grillzange aus Metall
- Brennsprit/Spiritus (Ethanol)
- Leitungswasser
- Kochsalz
- Messgefäss (z.B. Trinkglas)
- Kerze oder Teelicht
- Streichhölzer oder Feuerzeug
- Feuerfesten Experimentierplatz!

So geht’s
- Mischt in der tiefen Schale einen Teil Alkohol mit einem Teil Wasser. Gebt einen gestrichenen Teelöffel Kochsalz dazu und rührt um, bis das Salz sich weitestgehend gelöst hat.
- Stellt die Kerze auf der feuerfesten Unterlage oder z.B. im Badezimmer bereit und zündet sie an (behaltet die Schale mit dem Alkoholgemisch und die Brennsprit-Vorratsflasche abseits von Kerze und Feuerquelle!).
- Greift den Geldschein an einem Ende mit der Pinzette oder Zange und tränkt ihn vollständig im Alkohol-Wasser-Gemisch.

- Haltet den triefnassen Schein kurz in die Kerzenflamme und dann weiter über die feuerfeste Unterlage.
Achtung! Es kann passieren, dass brennender Alkohol auf die Unterlage tropft. Das ist nicht weiter schlimm, denn er brennt innerhalb von Augenblicken aus. Aber die Unterlage muss deshalb unbedingt feuerfest sein!
Tragt beim Geld verbrennen zudem Kleidung aus schwer entflammbarer Baumwolle und ggfs. Schutzbrille. Bei der Durchführung mit meiner Tiegelzange (ca. 15 bis 20cm Abstand zwischen Feuer und Hand) habe ich die Wärme der Flammen deutlich, aber nicht unangenehm gespürt. Ich empfehle also ein mindestens ebenso langes feuerfestes Haltewerkzeug. Die Duschwanne als Experimentierplatz bietet übrigens nicht nur durch den hohen Rand, sondern auch durch die darüber bereithängende Dusche zusätzliche Sicherheit.
Das könnt ihr beobachten
Der triefnasse Geldschein geht sofort in Flammen auf…oder? Denn obwohl der Schein für ein paar Sekunden in ausladenden, bläulich bis orangegelben Flammen steht, bleibt er unversehrt! Der Versuch funktioniert mit der jüngsten Euro-Serie ebenso wie mit den neuesten Schweizer Franken. Wenn ihr den Geldschein noch einmal in der Flüssigkeit tränkt, könnt ihr den Versuch auch gleich nach dem ersten Durchgang wiederholen.
Geld verbrennen ohne Folgen: Obwohl ich hier vorsichtigerweise eine 10-Euro- bzw. 10-Franken-Note verwendet habe, funktioniert das Experiment mit allen Nennwerten. Verschafft eurem Publikum also ruhig den ultimativen Schreckmoment, indem ihr einen Hunderter anzündet.
Entsorgung
Die nassen Geldscheine könnt ihr einfach zum Trocknen aufhängen und anschliessend normal weiterverwenden. Das Alkohol-Wasser-Gemisch könnt ihr mit viel Wasser in den Abfluss entsorgen.
Wie kann man Geld verbrennen, ohne dass es zerstört wird?
Was tatsächlich reagiert
Brennsprit, genauer Ethanol, verbrennt mit Luftsauerstoff zu Kohlenstoffdioxid und Wasser:
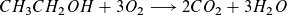
Bei der Verbrennung wird Energie frei, die wir als Leuchten der Flammen sehen und als Wärme spüren können. Die auf vergleichbare Weise in der Kerzenflamme freiwerdende Wärme (das „Kerzenwachs“ Paraffin besteht aus Molekülen aus Kohlenstoff- und Wasserstoff-Atomen, die bei ihrer Verbrennung ebenfalls Kohlenstoffdioxid und Wasser bilden) reicht aus, um den flüssigen Ethanol, mit dem der Geldschein getränkt ist, sofort zu entzünden. Das Gleiche gilt eigentlich für das Papier und die Kunststoffe, aus denen eine Banknote besteht.
Schutz durch Wasser
Die Flüssigkeit, mit welcher euer Schein getränkt ist, besteht jedoch zur Hälfte aus Wasser, welches nicht brennt, dafür aber in der Wärme der Flamme verdampft. Und beim Verdampfen geschieht dasselbe wie beim Schmelzen: Die Wassermoleküle nehmen Wärme auf, um von einer geregelten Anordnung zu mehr Bewegungsfreiheit zu kommen. In flüssigem Wasser kleben die gegeneinander beweglichen Moleküle nämlich stets aneinander, während sie in Wasserdampf frei im Raum herumfliegen.
Wasser ist nun ein Stoff, der beim Verdampfen besonders viel Wärme aufnehmen kann. Sein hoher Schmelzpunkt von 100°C gibt uns eine Idee davon (zum Vergleich: Schwefelwasserstoff, H2S, der aus fast gleichartigen Molekülen aufgebaut ist, ist bereits bei Raumtemperatur gasförmig!). Während die bei der Verbrennung des Ethanols freigesetzte Energie also Wasser zum Verdampfen bringt, bleibt um den Geldschein nicht genügend Wärme übrig, um das Material ebenfalls zu entzünden!
Der Schmelzpunkt von Ethanol ist mit 78°C übrigens auch niedriger als der von Wasser. Der Ethanol im und auf dem Schein verdampft also noch eher als das Wasser. Was also tatsächlich brennt, ist nicht der flüssige Ethanol im Geldschein, sondern Ethanol-Dampf drumherum.
Fazit
Der Geldschein selbst geht in diesem Experiment aus zwei Gründen nicht in Flammen auf:
- Die heissen Flammen entstehen nicht am Geldschein, sondern darum herum.
- Verdampfendes Wasser in und um den Schein ‚verbraucht‘ so viel Wärme, dass das Geld nicht heiss genug wird, um selbst in Flammen aufzugehen.
Aus vergleichbaren Gründen brennt übrigens auch der Docht einer Kerze nicht sofort nieder, sondern verkohlt langsam der schrumpfenden Wachskerze folgend. Auch das Paraffin verdampft, bevor es in der Umgebung des Dochts verbrennt! In „Chemische Spielereien“, dem Buch zu Keinsteins Kiste, könnt ihr die spannenden Einzelheiten zu den Vorgängen in Kerzenflammen nachlesen und weitere feurige Experimente machen.
Und an welche Geldsummen traut ihr euch beim Anzünden so ran?



 oder Zinkiodid (ZnI2)
oder Zinkiodid (ZnI2)