Halloween zu Hause: Schaurige Geräusche für eure Gruselgeschichten und wie sie entstehen
Die unheimlichste Nacht des Jahres rückt näher – und das in einer denkbar ungünstigen Zeit – zumindest, was grosse Spukpartys betrifft. Aber richtig schaurig-schön wird so eine Nacht doch erst, wenn ihr sie im gemütlichen Kreis eurer Lieben verbringt und euch bei schummrigem Licht Gruselgeschichten erzählt. Damit die auch so richtig unter die Haut gehen, könnt ihr sie mit einfachen Zutaten mit passenden Gruselgeräuschen garnieren.
Hier sind einige Beispiele für euch!
Gruselige Geräusche mit Material aus dem Haushalt erzeugt
Heulender Wind (oder ein Gespenst?)
Blast mit leicht geöffnetem Mund und wechselnder Kraft waagerecht über die Öffnung einer Glasflasche. Es entsteht ein an- und abschwellender dunkler Heulton. Probiert aus, wie ihr für das passende Wind- (oder Gespenster-) Geheul blasen müsst. Macht zwischendurch Pausen, bevor euch vom Blasen schwindelig wird! Wenn ihr etwas Wasser in die Flasche füllt, wird der Ton höher.
Mächtiger Donner
Schüttelt ein dünnes Blech oder eine grosse Pappe kurz (oder länger für entfernten Donner) und kräftig.
Monsterstimmen
Schnarrende Vögel
Legt zwei Blatt DIN-A4-Papier so übereinander, dass das untere Blatt an der schmalen Kante gut einen Zentimeter unter dem oberen hervorschaut. Haltet die Blätter an den Enden dieser schmalen Kante und spannt sie straff. Blast nun scharf mit spitzen Lippen (fast) waagerecht gegen die Kante. Mit etwas Übung könnt ihr dem Papier ein laut schnarrendes Geräusch entlocken. Mir gelingt das am besten, wenn ich ein wenig von oben auf die doppelte Kante blase. Achtung: Macht auch hier ab und zu eine Pause, bevor euch schwindelig wird!
Quäkende Gnome
Schneidet aus Frischhaltefolie oder Zellophan ein Quadrat mit 5 bis 7 Zentimeter Kantenlänge. Greift zwei gegenüberliegende Kanten mit den Händen und spannt die Folie straff, während ihr sie vor euren Mund hebt. Blast nun wiederum sehr kräftig mit spitzen Lippen aus sehr kurzem Abstand gegen die euch zugewandte freie Kante. Mit etwas Übung könnt ihr so ein fies quäkendes Geräusch erzeugen. Wie bei allen geblasenen Geräuschen gilt: Pausen machen, bevor euch schwindelig wird!
Schaurige Geisterstimme
Sprecht durch ein langes Rohr, zum Beispiel eine leere Küchentuchrolle, in einen Eimer. Eure Stimme wird dumpf und hohl klingen. Durch Veränderung eurer Stimmlage könnt ihr den Effekt bei Bedarf anpassen.
Das blubbernde Schleim-Monster
Füllt eine tiefe Schale mit Wasser. Sprecht, am besten tonlos raunend, während ihr die Lippen so nah an den Rand und den Wasserspiegel haltet, dass der dabei ausgeatmete Luftstrom das Wasser blubbern lässt.
Der Todesschrei
Für diesen Effekt braucht ihr ein wenig technische Unterstützung – in Form eines Aufnahme- oder Sound-Bearbeitungs-Apps oder -geräts, das Aufnahmen mit unterschiedlicher Geschwindigkeit abspielen kann. Nehmt das Geschrei eines Babys auf (ein kurzer Ausschnitt reicht!) und spielt die Aufnahme langsamer ab (bzw. bearbeitet sie entsprechend). Probiert vor dem Einsatz aus, mit welcher Geschwindigkeit der Schrei am besten klingt. Spielt die vorbereitete Datei dann während eurer Geschichte ab.
Herzklopfen
Bei so viel Grusel fehlt jetzt eigentlich nur noch das passende angstvolle Herzklopfen. Nehmt dazu ein Küchen und greift es fest mit beiden Händen wenige Zentimeter unterhalb einer Kante. Macht die Hände dabei zu Fäusten, sodass die Daumen flach auf den gerollten Fingern und dem Tuch liegen und nach oben bzw. vorne weisen. Zwischen euren beiden Daumen sollten nun 15 bis 20 cm Stoff liegen. Strafft das Tuch zwischen euren Daumen leicht. Führt dann die Fäuste ein Stück zusammen und zieht das Tuch ruckartig wieder stramm. Es ertönt ein dumpfes „Bumm“, das einem Herzton sehr ähnlich ist. Wenn ihr unmittelbar vor dem nächsten Herzton locker lasst und das Tuch wiederum schnell stramm zieht, könnt ihr einen Herzrhythmus „da-Bumm – da-Bumm – da-Bumm“ nachstellen. Je schneller folgend ihr locker lasst und stramm zieht, desto höher steigt der Puls!
Wie Geräusche entstehen und wie wir sie hören können
Aber wie funktioniert das alles eigentlich?
Was ist Schall?
Vielleicht wisst ihr bereits: Schall besteht aus sich ausbreitenden Wellen. Dabei handelt es sich aber nicht um die bekannten Wellen mit Auf- und Abbewegungen, wie ihr sie von Wasserwellen oder Wellenlinien kennt. Die sind nämlich nur eine Spielart dessen, was Wellen tatsächlich sind: Nämlich wiederkehrende Muster von physikalischen Vorgängen, die sich im Raum ausbreiten.
Bei den Wellen, die wir in unserer Alltagswelt erleben, zum Beispiel den Wasserwellen, handelt es sich um Bewegungsmuster: Wenn Wellen über einen See laufen, bewegt sich die Wasseroberfläche immer wieder auf und ab. Und damit Bewegungsmuster sich ausbreiten können, braucht es etwas, das sich bewegt. Physiker nennen dieses „Etwas“ ein Medium. Das Medium, in dem sich Wasserwellen ausbreiten, ist zum Beispiel Wasser – oder besser dessen Oberfläche.
Luft als Medium für Schallwellen
Das Medium, in dem sich die Schallwellen ausbreiten, die wir hören, ist hingegen Luft. Und die wiederum besteht aus unzähligen winzigkleinen Teilchen, die sich durch ständiges Herumgewusel auf Abstand halten. Das Gewusel können wir freilich nicht wahrnehmen, sodass uns die Luft in einem geschlossenen Raum in der Regel als stehend erscheint.
Nichts desto trotz können wir mit der Hand durch die Luft streichen oder darin herum laufen: Die winzigen Luftteilchen sind beweglich – sie lassen sich herumschieben. Wenn man den Teilchen in einem bestimmten Bereich der Luft einen kräftigen Schubs gibt, kann man sie sogar enger zusammenschieben, als sie sonst in stehender Luft verteilt sind. Aber nur für einen kurzen Moment. Denn die zusammengeschobenen Teilchen stossen in ihrer Wuselei gegeneinander und gegen jene Teilchen, die hinter ihnen sind – und schieben auch diese zusammen. So erkämpfen sich die anfangs zusammengeschobenen Teilchen für einen Augenblick besonders viel Platz – bevor ihre Nachbarn sie wieder auf den anfänglichen Abstand zwingen.
Indessen drängen die weiter vom Schubs entfernten Teilchen wiederum die nächsten Teilchen zusammen. Das Gedränge – und der darauf folgende vermehrte Platz – wandern also fort vom Ort des Schubses in den luftgefüllten Raum hinein.

Schallwellen sind wandernde Dichteveränderungen
Wie dicht Teilchen in einem Gas gedrängt sind, messen Physiker mit einer Grösse, die sie passenderweise „Dichte“ nennen: Die Anzahl der Teilchen (gemessen wird ihre Gesamtmasse) in einem bestimmten Raum (Volumen). Wie beschrieben lässt sich die Dichte eines Gases durch Anschubsen grösserer Mengen Gasteilchen leicht verändern. Schallwellen sind somit nichts anderes als wiederkehrende Veränderungen der Dichte eines Gases wie Luft, die sich in diesem Gas ausbreiten.
Während die Bewegung bei einer Wasserwelle (dabei ändert sich die Höhe des Wasserspiegels in wiederkehrender Weise) senkrecht zur Ausbreitungsrichtung abläuft (Der Wasserspiegel bewegt sich auf und ab, die Wellen laufen aber die Oberfläche entlang), findet die Bewegung bei Schallwellen in die gleiche Richtung wie die Ausbreitung statt. Schallwellen sind damit „Längswellen“, während man Wasserwellen „Querwellen“ nennt.
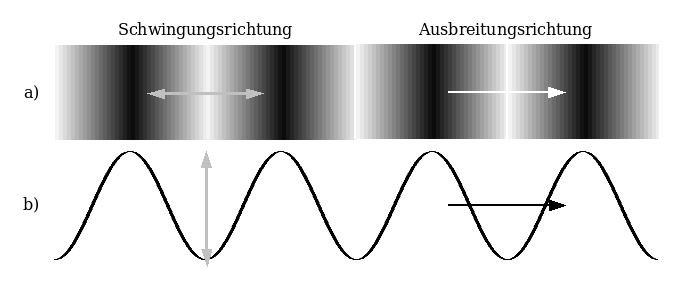
Wie wird Schall übertragen?
Wenn ihr mit dem Küchentuch Herztöne nachmacht, versetzt ihr den Luftteilchen durch das schnelle Straffen des Tuchs einen Schubs nach vorn. Die Luftteilchen vor dem Tuch werden zusammengeschoben und diese Verdichtung breitet sich in der Luft in alle Richtungen aus, bis sie auf ein festes Hindernis stösst. Das könnte eine Wand sein – oder die Haut, die unser Mittelohr verschliesst und „Trommelfell“ genannt wird.
Sobald sich die Luftteilchen direkt vor unserem Trommelfell verdichtet haben und wieder auseinander streben, schubsen sie die Teilchen des Trommelfells an. Das Trommelfell wiederum ist ein Feststoff. Das heisst, jedes Teilchen hat darin seinen festen Platz. So schwingen alle Teilchen des Trommelfells durch den Schubs gemeinsam nach innen, wodurch sie eine Reihe kleiner Knochen – die Gehörknöchelchen – in Bewegung versetzen.
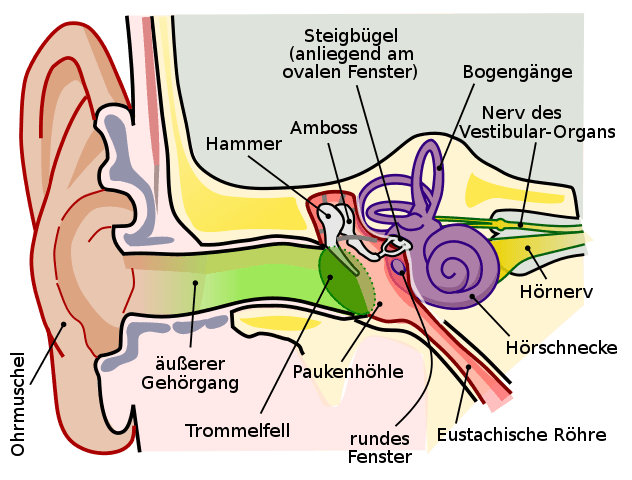
Das letzte von ihnen, seiner Form wegen „Steigbügel“ genannt, klopft schliesslich gegen die „Schnecke“, die eine Art Sensor darstellt, welcher das Klopfen in Nervenimpulse übersetzt. Die werden an den Zentralcomputer – unser Gehirn – weitergeleitet, der uns dann ausrechnet, was wir da gehört haben.
Töne oder Geräusche?
Die denkbar einfachste Form von Schall ist eine einfache, sich gleichmässig ausbreitende Schallwelle mit gleichbleibender Frequenz. Was das schon wieder ist? Noch eine physikalische Grösse, mit der man die Geschwindigkeit misst, in der dichtere und dünnere Luft aufeinander folgen.
Wenn wir den Kammerton A hören, nach dem Musiker ihre Instrumente stimmen, erreichen beispielsweise 440 Verdichtungen in einer Sekunde unser Ohr. Physiker sagen „die Frequenz des Tons beträgt 440 Hertz (Hz)“. Das klingt viel, ist es aber nicht. Grundsätzlich gilt: Je höher die Frequenz der Schallwellen, desto höher ist der Ton. Unser Gehör ist dafür geschaffen, Töne zwischen etwa 30 Hz und 20’000 Hz (20 Kilohertz) wahrzunehmen! Schallwellen mit noch höheren Frequenzen nennt man „Ultraschall“. Die können wir Menschen nicht mehr hören, manche Tiere, wie z.B. Fledermäuse, hingegen schon.
So einfache, reine Töne sind in unserer Welt jedoch selten. Selbst gut gestimmte Musikinstrumente geben stets eine Vielfalt von Schallwellen von sich. Wenn deren – zweifellos regelmässiges – Muster unsere Ohren erreicht, errechnet das Gehirn daraus die typische Klangfarbe des Instruments.
Am häufigsten erreichen jedoch hochkomplizierte Wellengebilde – oder regelrechter Wellensalat – unsere Ohren, die sich mit bestimmten Frequenzen nicht mehr beschreiben lassen. Die interpretiert das Gehirn als das, was wir Geräusche nennen. Im Laufe eines Menschenlebens lernt es eine grosse Zahl davon kennen und ordnet sie Eindrücken, Gefühlen und Ursachen zu.
Manche Geräusche können uns unangenehm sein (besonders, wenn unser Gehirn sie mit gruseligen Dingen verknüpft hat). Dahingegen empfinden wir Töne mit mittelgrossen Frequenzen meist als angenehm – sofern sie nicht zu laut sind.
Was ist „laut“?
Je dichter man Gasteilchen zusammendrängt, desto heftiger stossen sie gegeneinander und streben so auseinander. In einem dichten Gas herrscht also ein hoher Druck. Dementsprechend nennen Physiker auch das Ausmass, in welchem Gasteilchen in Schallwellen zusammengeschoben werden, den „Schalldruck“. Ein höherer Schalldruck führt dazu, dass die Schallwellen das Trommelfell heftiger schwingen und den Steigbügel folglich heftiger klopfen lassen. So werden stärkere Nervenimpulse erzeugt als bei niedrigerem Schalldruck.
Stark vereinfacht lässt sich also sagen: Je höher der Schalldruck eines Tons oder Geräuschs, desto lauter ist er. Tatsächlich kommen jedoch noch einige Faktoren – nicht zuletzt persönliche Eigenheiten eines jeden Menschen – dazu, wenn wir bestimmen wollen, was wir nun als ‚laut‘ empfinden und was nicht.
Schalldruckpegel: Eine lange Skala wird überschaubar
Möchte man den Schalldruck von Alltagsgeräuschen als wiederkehrende Veränderung des normalen Luftdrucks messen, braucht man dafür eine sehr, sehr lange Skala. Physiker verwenden dafür die gleiche Einheit wie für den Luftdruck auch – das Pascal (Pa). Ein Schalldruck im Alltag kann dabei etwa zwischen den 60 Millionstel Pascal (0,00006 Pa !) eines Blätterrauschens direkt am Ohr und den 600 Pascal eines Düsenflugzeugs, das in 30 Metern Entfernung abhebt, betragen.
Das ist im Alltag natürlich sehr unpraktisch, wenn es darum geht, euch im Alltag ein Gefühl zu vermitteln, wie laut etwas ist. Deshalb gibt man statt des Schalldrucks in der Regel den Schalldruckpegel in Dezibel (dB), also Zehntel „Bel“ an. Die Zahlen auf der Dezibel-Skala geben uns -vereinfacht gesagt – einen Eindruck, wie viele Nullen vor oder hinter dem Komma die Werte des Schalldrucks haben (es handelt sich um eine logarithmische Skala – die Umrechnung des Schalldrucks in Dezibel ist aber nicht so simpel, das man den Zusammenhang gleich mit dem blossen Auge erkennt).
Das Blätterrauschen beispielsweise bringt darauf einen Schalldruckpegel von 10 dB mit sich, während das Düsenflugzeug ganze 150 dB erzeugt. Es heisst, dass die kurzfristige Einwirkung von Schalldruckpegeln ab 120 dB bereits Gehörschäden verursachen kann. Deshalb tragen Flughafenangestellte auf dem Rollfeld meist einen Gehörschutz in Kopfhöhrerform (hier in der Schweiz nach dem führenden Modell des Militärs „Pamir“ genannt). Die Schalen, die um die Ohren liegen, absorbieren die heftigen Bewegungen, die Schallwellen unter den Luftteilchen verursachen und schubsen die Luft zwischen Ohr und Schale nur ganz schwach (oder gar nicht) an.
Künstliche Ohren und Stimmen
…kennt ihr alle. Denn es handelt sich um Mikrofone und Lautsprecher. Ein Mikrofon enthält Bauteile bzw. Sensoren, die von Schallwellen ähnlich angeschubst werden wie die Bestandteile unseres Innenohrs. Statt durch Nervenbahnen werden so erzeugte elektrische Signale durch Kabel in ein Aufnahmegerät weitergeleitet, das den Job des Gehirns übernimmt und die Töne und Geräusche speichert.
In einem Lautsprecher bringen elektrische Signale eine Membran, also eine Art Folie, zum Schwingen, die dann wiederum die Luft anschubst und so Schallwellen erzeugt.
Welche Geräusche sind am Halloween-tauglichsten?
Nun ist eure Kreativität gefragt: Abgesehen von meinen Beispielen oben – Welche weiteren Möglichkeiten kennt oder findet ihr, um Luftteilchen anzuschubsen und möglichst gruselige Geräusche zu erzeugen? Und welches ist eurer Meinung nach das schaurig-schönste Geräusch für Halloween?
Mehr Schauriges zu Halloween findet ihr hier in Keinsteins Kiste:
Kürbis und kaltes Feuer – Deko-Tipps für Forscher