Wenn ihr meine Kanäle verfolgt, habt ihr es wahrscheinlich schon mitbekommen: Ich schreibe an einem Mitmachbuch für Forscherkinder – über Wasser. Das ist schliesslich ein ganz besonderer Stoff und megaspannend. Da bleibt es nicht aus, dass Wasser allerorts, auch in den sozialen Medien, meine besondere Aufmerksamkeit weckt. So ist es mir unlängst in einer Kombination begegnet, die spontanes Chemiker-Augenrollen bewirkte: Als belebtes Wasser. Oder war es energetisiertes Wasser? Vitalisiertes Wasser? Aktiviertes Wasser? Magnetisiertes Wasser? Hexagonales Wasser? Oder sogar Grander-Wasser?
Merkt ihr was? So viele verschiedene und nichtssagende Begriffe für praktisch das gleiche. Und das ist nur eine Auswahl der Existierenden! Allein auf Psiram habe ich eine Liste mit 144 Firmen und Produktlinien rund um „verbessertes“ Wasser in vermutlich ebenso vielen Variationen gefunden! Also, worum geht es hier eigentlich? Um Wasser, das in irgendeiner Weise verbessert sein – und folglich positive Wirkungen auf uns haben soll.
Wie sollen wir an belebtes Wasser gelangen?
Die erwähnten Hersteller bieten entweder Gerätschaften und Anlagen zur „Verbesserung“ von Leitungswasser im eigenen Haushalt an oder sie verkaufen es fixfertig , zum Beispiel in Getränkeflaschen. Auffällig ist bei praktisch all diesen Produkten der hohe bis überrissene Preis.
Brauchen wir verbessertes bzw. belebtes Wasser?
Nein. In der Schweiz, Deutschland und Österreich geniessen wir das Privileg, einwandfreies Leitungswasser zu haben, das wir ohne Bedenken trinken können. In der Schweiz gilt das überdies für einen Grossteil der öffentlichen Brunnen. Ausserdem können wir jederzeit ebenso einwandfreies Mineralwasser in Supermärkten kaufen. Und Leitungs- wie Mineralwasser bieten alles, was wir vom Wasser zum Gesundbleiben brauchen.
Was kann belebtes Wasser dann besser?
Ihr ahnt es sicher schon: Nichts. Zumindest nicht über einen Placeboeffekt hinaus. Und den könnt ihr wesentlich billiger haben.
Ist belebtes Wasser dann womöglich gefährlich?
Nicht direkt. Ausser für euren Geldbeutel. Denn Produkte rund um belebtes Wasser sind in der Regel mächtig teuer. Und bewirken, wie erwähnt, nichts.
Indirekt können sie aber zum Problem werden. Nämlich dann, wenn sie ein falsches Gefühl von Sicherheit vermitteln („das Wasser hält mich schon gesund“). Wenn aus diesem Sicherheitsgefühl heraus Arztbesuche verzögert, Medikamente nicht genommen oder andere wichtige Massnahmen vernachlässigt werden (Infektionsschutz ist zur Zeit ja ein ganz grosses Thema!), kann das schwerwiegende oder im schlimmsten Fall tödliche Folgen haben.
Aus diesem Anlass schreibe ich den Artikel: Nicht nur um eurer Geldbeutel willen, sondern vor allem, um euch dabei zu helfen, wirklich Gutes für die Gesundheit eurer Familie zu tun.
Um euch zu zeigen, warum belebtes Wasser nicht wirken kann, habe ich zunächst eine kleine Einführung in die Chemie des Wassers für euch.
Kleine Wasserkunde
1. Wasser ist eine Verbindung
Wasser ist einer von vielen Stoffen, aus denen unsere Welt aufgebaut ist. Dabei ist es zweifellos einer der wichtigsten Stoffe unserer Alltagswelt. Nahezu jeder von euch wird die chemische Formel, genauer die Summenformel, von Wasser schon einmal gesehen haben: H2O.
Diese Formel verrät uns schon eine ganze Menge über diesen Stoff. Sie sagt uns: Wasser besteht aus Molekülen. Ein Wassermolekül besteht wiederum aus zwei Wasserstoffatomen und einem Sauerstoffatom. Das bedeutet, Wasser ist kein Element, wie antike Philosophen annahmen, sondern eine chemische Verbindung. Ein chemisches Element besteht nämlich nur aus einer Sorte von Atomen – Wasser aber aus zwei Atomsorten.
2. Wassermoleküle sind gewinkelt
Die Atome in einem Molekül sind über Elektronenpaarbindungen miteinander verknüpft. Zwei Elektronen bilden eine solche Bindung. Die Regeln der Chemie besagen, dass ein Sauerstoffatom zwei Bindungen bilden kann und überdies noch zwei weitere, nichtbindende Elektronenpaare hat. Ein Wasserstoffatom kann dagegen nur eine Bindung bilden. Daraus ergibt sich die Strukturformel für Wasser:
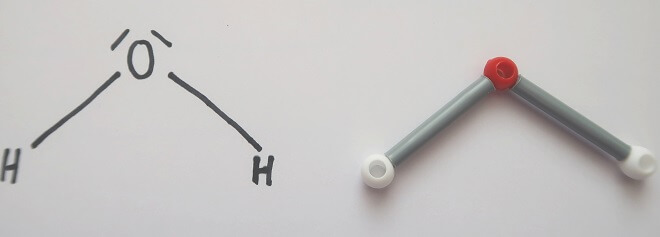
Warum stehen die drei Atome nicht einfach in einer Reihe? Jedes Elektron trägt eine negative elektrische Ladung. Und gleiche elektrische Ladungen stossen einander ab. So gehen die vier äusseren Elektronenpaare – zwei Bindungen und zwei nichtbindende Paare – des Sauerstoffs auf grösstmöglichen Abstand zueinander. Und der entspricht annähernd der Nachbildung eines Tetraeders (einer regelmässigen dreieckigen Pyramide). Das Sauerstoffatom befindet sich im Zentrum dieser Pyramide, die beiden Wasserstoffatome und die Enden der nichtbindenden Elektronenpaare an den Ecken. Zeichnet man nun einen Längsschnitt, auf dem alle drei Atome liegen, durch das Gebilde, erhält man die gewinkelte Strukturformel des Wassermoleküls.
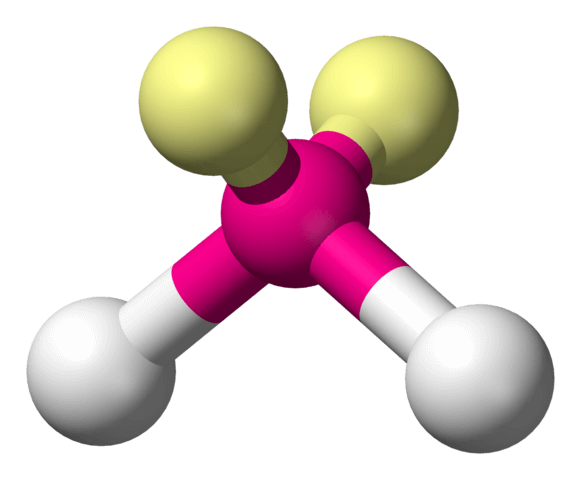
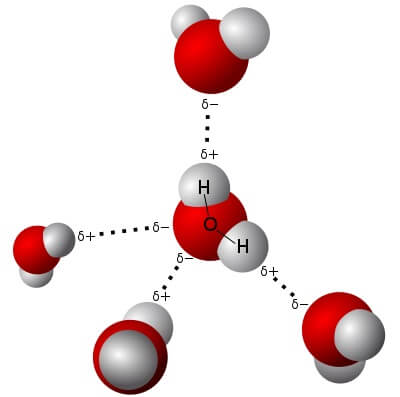
3. Wassermoleküle sind elektrische Dipole
Nun verhält es sich so, dass Sauerstoffatome die Elektronen, auch jene in den Bindungen, viel stärker zu sich hinziehen als Wasserstoffatome. Deshalb ist in der Nähe des Sauerstoff-Atoms im Wassermolekül sehr viel mehr von den bindenden Elektronen anzutreffen als in der Nähe der Wasserstoffatome. Da jedes Elektron eine negative elektrische Ladung trägt, heisst das, dass am Sauerstoffatom mehr negative Ladung zu finden ist, als dort sein sollte, während an den Wasserstoffatomen zu wenig negative Ladung zu finden ist. „Mehr“ und „zu wenig“ stehen dabei für Ladungsmengen, die kleiner als die Gesamtladung eines Elektrons sind.
Nicht desto trotz bedeutet das, dass der Scheitel des Wassermoleküls (mit dem Sauerstoffatom) ein wenig negativ geladen ist, während sein „breites“ Ende mit den Wasserstoffatomen ein wenig positiv geladen ist (denn die positive Ladung der Atomkerne macht sich wegen des Elektronenmangels bemerkbar). Ein Wassermolekül hat also zwei elektrische Pole – deshalb nennt man es einen elektrischen Dipol.
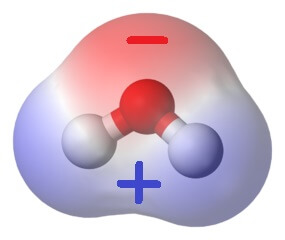
Verschiedene elektrische Ladungen aber ziehen einander an. So zieht der negativ geladene Scheitel eines Wassermoleküls unweigerlich die Breitseite seines nächsten Nachbarn an. Ebenso werden Wassermoleküle von anderen elektrischen Polen angezogen. Das könnt ihr mit diesem Experiment ganz leicht zu Hause zeigen!
4. Wasser ist sowohl eine Säure als auch eine Base
Die sehr „schiefe“ Verteilung der Elektronen im Wassermolekül führt aber nicht nur zu zwei elektrischen Polen, sondern auch dazu, dass die Bindungen zwischen Sauerstoff- und Wasserstoffatomen sehr brüchig sind. Ein Wassermolekül kann also sehr leicht einen Wasserstoffatomkern (ein H+-Ion) verlieren. Damit ist Wasser eine Säure. Ebensogut kann ein Sauerstoffatom eines seiner nichtbindenden Elektronenpaare verwenden, um solch ein verlorenes H+-Ion zu binden. Damit ist Wasser eine Base.
Von einem Wassermolekül, das ein H+-Ion verloren hat, bleibt ein Hydroxid-Ion (OH–):
Ein Wassermolekül, das ein verlorenes H+-Ion aufnimmt, wird damit zum Hydronium-Ion (H3O+):
Tatsächlich kommt es ständig vor, dass ein Wassermolekül ein H+-Ion verliert, welches in einem anderen Wassermolekül Unterschlupf findet:
Ebenso kann das H3O+-Ion das zusätzliche H+-Ion wieder zurückgeben. So gibt es in einer Menge Wasser ein ständiges Herumgereiche von H+-Ionen zwischen den Wassermolekülen. Insgesamt findet man in einem Liter reinem Wasser zu jedem Zeitpunkt 0,0000001 mol oder 10-7 H3O+ – und ebenso viele OH– -Ionen. Der Exponent der Zahl der H+-Ionen (als Zehnerpotenz) in einem Liter Flüssigkeit mit umgekehrtem Vorzeichen ist nichts anderes als der pH-Wert. Reines Wasser hat also stets einen pH-Wert von 7.
5. Wassermoleküle können Wasserstoffbrücken bilden
Allerdings wäre das Ganze viel zu einfach, wenn man so strikt zwischen Bindung und keiner Bindung unterscheiden könnte. Das kann man nämlich nicht. Die Elektronen einer Bindung zwischen Sauerstoff- und Wasserstoff-Atom im Wassermolekül sind nämlich so ungleich verteilt, dass ein entblösster Wasserstoffkern sich in die dichte Elektronenhülle eines Sauerstoffatoms im Nachbarmolekül „einkuscheln“ kann, ohne sich dazu von „seinem“ Wassermolekül lösen zu müssen. Das nennen die Chemiker eine Wasserstoffbrücken-Bindung.
Das Resultat ist eine Anziehung zwischen Wassermolekülen, die noch stärker ist als die Anziehung zwischen ihren unterschiedlichen Ladungen (aber viel weniger stark als eine echte Elektronenpaarbindung). Sie zeigt sich zum Beispiel in dem enorm hohen Siedepunkt (100°C) von Wasser – da diese starke Anziehung überwunden werden muss, wenn das Wasser gasförmig werden will. Zum Vergleich: Der sehr eng verwandte Schwefelwasserstoff, H2S, der keine Wasserstoffbrücken bildet, siedet schon bei -60°C!
6. Wasserstoffbrücken entstehen zufällig und sind extrem kurzlebig
Die Darstellung von flüssigem Wasser als H2O ist somit im Grunde genommen eine Vereinfachung. Tatsächlich besteht flüssiges Wasser aus einem wilden Gemisch von Atomen, die sich mal als H2O, mal als H3O+ bzw. OH– gruppieren und sich noch viel öfter zu irgendetwas dazwischen zusammenkuscheln. Dabei kann es passieren, dass einige wenige Atome sich zu gut strukturierten Gruppen, sogenannten Clustern, zusammenrotten.
Aber dieser Austausch findet an jedem Ort im Wasser gleichzeitig und im Picosekundentakt statt. Das heisst, würde man ein Foto von den Bindungen zwischen Atomen in flüssigem Wasser machen, dann sähe ein zweites Bild davon, nur 0,000 000 000 001 Sekunden später aufgenommen, völlig anders aus – einschliesslich komplett anderer Molekül-Cluster.
Und das geschieht ganz spontan und zufällig. Die Triebkraft dafür ist zum Einen Wärmeenergie. Mit über 273°C über dem absoluten Nullpunkt (bei Atmosphärendruck) ist flüssiges Wasser nämlich immer ziemlich warm, auch wenn unsere Körper oft anderer Meinung sind. Und zum Anderen hilft das absolute Chaos, das der ständige Umbau mit sich bringt. Die Natur liebt nämlich Chaos – von Physikern und Chemikern „Entropie“ genannt – so sehr, dass sie ohne Energie von aussen ganz von selbst nach grösstmöglicher Unordnung strebt.
Warum man Wasser nicht beleben kann
Die meisten Anbieter in der „Belebtes-Wasser“-Branche behaupten, sie könnten flüssiges Wasser „besser“ machen, indem sie ihm irgendwie eine geordnetere Struktur geben. Einige fügen dem Wasser dafür Energie zu, andere berufen sich darauf, genau das nicht zu tun. Eines haben jedoch alle gemeinsam: Es kommt nichts dabei herum. Denn:
Wasser kann man nicht mit Energieeinsatz „beleben“, indem
- Man man es über eine eingelegte Antenne mit elektromagnetischen Wellen berieselt. Würde man das mit Mikrowellen (der richtigen Frequenz bzw. Wellenlänge) machen, würde das Wasser allenfalls warm (so funktioniert ein Mikrowellenherd). Denn Mikrowellen der passenden Länge können elektrische Dipole wie Wassermoleküle in Drehung versetzen. Und die nehmen wir, wie jede andere ungerichtete Bewegung von Teilchen, als Wärme wahr. Infrarotwellen, die energiereicher als Mikrowellen sind, können ebenfalls wärmen – indem sie die Bindungen in Molekülen zum Schwingen bringen. Elektromagnetische Wellen mit weniger Energie bewirken hingegen nichts.
- Man es mittels Elektrolyse ionisiert. Das mag zwar vorstellbar sein (wenn man vermeiden kann, dass statt irgendwelcher Ionen Moleküle von Wasserstoff- und Sauerstoff-Gas entstehen). Allerdings sorgt der stetige Austausch zwischen den Wasserteilchen dafür, dass sich nach dem Ausstellen der Elektrolysevorrichtung innert Picosekunden das oben erwähnte Gleichgewicht zwischen Wasser, H3O+– und OH–-Ionen wieder einstellt. Mit anderen Worten: So schnell, wie der pH-Wert von Wasser – sollte es ionisiert worden sein – wieder 7 ist, kann man es unmöglich trinken – geschweige denn anschauen.
- Man es ebenfalls durch Elektrolyse mit Wasserstoff anreichert. „Wasserstoffwasser“ ist besonders in Japan als Fertigprodukt im Supermarkt beliebt. Grundsätzlich lässt sich Wasserstoff durch Elektrolyse von Wasser herstellen. Allerdings löst der sich nicht besonders gut in Wasser und kann in die allermeisten Festkörper (z.B Getränkeflaschen) problemlos ein- und durch sie hindurch wandern. So lässt sich Wasser nicht nur kaum mit Wasserstoff anreichern, sondern überdies auch kaum lagern. Dazu kommt, dass der menschliche Körper elementaren Wasserstoff (H2) gar nicht verwerten kann.
- Man Wasser in ein (unveränderliches) Magnetfeld einbringt. Richtig ist: Elektrisch geladene Teilchen in Bewegung ändern im Magnetfeld ihre Bewegungsrichtung. Das gilt aber nur für Teilchen, die als Ganzes eine merkliche Ladung tragen. Wassermoleküle tragen zwar Ladungen, aber jedes von ihnen hat zwei gleich grosse, aber entgegengesetzte Ladungen, die einander aufheben. Von aussen gesehen bleibt so keine Ladung, auf die das Magnetfeld einen Einfluss haben könnte. Überdies ist Wasser ausschliesslich diamagnetisch und lässt sich daher nicht magnetisieren (Was hinter Dia-, Para- und Ferro-Magnetismus steckt erfahrt hier hier).
- Man Edelsteine hineinlegt, die irgendwelche „Schwingungen“ oder „Informationen“ in das Wasser übertragen sollen. Die einzigen Schwingungen, die so übertragen werden können, sind jene Bewegungen, die wir als Wärme wahrnehmen. Würde man die Steine vorher erhitzen, könnte man so allenfalls das Wasser erwärmen (so funktionieren ein Tauchsieder oder der „heisse Stein“ im Restaurant).
Wasser kann man erst recht nicht ohne Energiezufuhr beleben, indem
- Man in irgendeiner anderen Weise „Informationen“, „Schwingungen“ oder „Energie“ auf das Wasser überträgt (belebtes Wasser ‚im eigentlichen Sinn‘). Wie ihr in der kleinen Wasserkunde gelernt habt, hat flüssiges Wasser eine äusserst unstete Struktur: Seine Atome gruppieren sich in allerkürzesten Zeitabständen laufend neu. Das macht es zur Speicherung von Information für länger als 0,000 000 000 001 Sekunden vollkommen ungeeignet.
Kommt dazu – wie so oft – der ausdrückliche Verzicht auf Energie von aussen, gibt es zudem ein unlösbares Problem mit der Thermodynamik. Deren zweiter Hauptsatz besagt nämlich, dass die Schaffung von Ordnung in einem geschlossenen System ohne das Einbringen von Energie einfach nicht möglich ist. Und eine Struktur (z.B. in Form gespeicherter „Information“) in vormals chaotischem Wasser zu erzeugen, heisst Ordnung schaffen.
Das gilt gleichermassen für alle Spielarten belebten Wassers, ob sie nun belebtes Wasser, aktiviertes, vitalisiertes, levitiertes Wasser, „Grander-Wasser“ oder sonstwie heissen.
Aber der „Stand der Wissenschaft“ ist doch nicht unumstösslich?
Stimmt. Aber ein Grossteil dessen, was wir über Wasser wissen, ist so deutlich belegt, dass dort keine grossen Anpassungen des heutigen „Lehrbuchwissens“ mehr zu erwarten sind. Das gilt insbesondere für das unstete Betragen der Teilchen in flüssigem Wasser. Wir mögen zwar noch längst nicht alles über die erwähnten Wassercluster wissen. Doch das liegt eben gerade daran, dass diese Strukturen so kurzlebig sind, dass Wissenschaftler sie selbst mit hochtechnischen Apparaturen kaum vermessen können. Und ebendiese Kurzlebigkeit macht das Speichern von jedweder „Information“ in Wasser unmöglich.
Auch die Gesetze der Thermodynamik sind heute derart gut belegt, dass wir sie in unserer Welt getrost als unumstösslich annehmen können. Sollten Physiker dennoch jemals einen Weg finden, der am 2. Hauptsatz vorbei führt, dann nicht in der Welt, wie wir sie kennen, sondern unter höchst exotischen Bedingungen, die weit ausserhalb unserer persönlichen Reichweite liegen. Also nicht in unserem eigenen Keller oder einer mystischen Getränkefabrik.
Ausserdem haben sich die Wissenschaftler, die so gerne auf belastbare Studien pochen, sich nicht lumpen lassen. So gibt es auch Untersuchungen zur Wirksamkeit von belebtem Wasser auf Mensch, Tier und Pflanze – unabhängig von der Frage, ob sie mit heutigem Wissen theoretisch erklärbar wäre. Und hat man – unter belastbaren (also methodisch einwandfreien und wiederholbaren) Versuchsbedingungen – eine Wirkung gefunden? Nein.
Es gibt also weder eine nachweisliche Wirkung noch eine schlüssige Theorie, wie sie zustandekommen könnte. Mit anderen Worten: Belebtes Wasser ist demnach mit höchster Wahrscheinlichkeit ein reines Fantasieprodukt.
Wie ihr derartige Fantasieprodukte oder -angebote erkennen könnt
Einige auffällige Merkmale hat belebtes Wasser mit vielen anderen fragwürdigen Produkten und Angeboten im Gesundheitsbereich gemein: Es wird ihm eine so vielfältige Heilkraft nachgesagt, dass es leicht als Wundermittel durchgehen könnte.
- Was gleichermassen gegen alles von Hauterkrankungen über Magenbeschwerden, Migräne, Depressionen u.v.a.m. bis hin zu Krebs hilft, kann nicht wirklich nützen. Verschiedene Krankheiten haben verschiedene Ursachen, die verschiedene Behandlungen erfordern. Darüber hinaus ist in der Schweiz und Deutschland die Werbung für Wasser mit Heilversprechen gesetztlich verboten, was eine solche um so unseriöser macht.
- Ähnliches gilt für Angaben wie ‚hilft bei der „Entgiftung“ (Entschlackung,…). Die Notwendigkeit, Giftstoffe oder „Schlacken“ aus unserem Körper zu entfernen, ist ebenfalls ein Fantasieprodukt entsprechender Anbieter (denn das besorgen gesunde Leber und Nieren ganz allein).
- Beliebte „Buzzwörter“ aus dem Alternativheilkunde-Bereich in Beschreibungen können ein Hinweis sein, dass dem Produkt das wissenschaftliche Fundament fehlt: Neben den genannten Synonymen für belebtes Wasser bzw. Wasserbelebung sind das z.B. „Schwingungen„, „Energien“ (Naturwissenschaftler verwenden „Energie“ nie in der Plural!), oder „feinstofflich„, die allesamt bedeutungslose Worthülsen sind. Dazu kommen die Namen Nicola Tesla, wenn es um mysteriöse Technik geht, oder – speziell im Wasserbereich – Gerald H. Pollack oder Masaru Emoto, auf deren nicht haltbare Theorien sich viele „Wasserbeleber“ beziehen, sowie Johann Grander.
Dazu kommen einige eigene Merkmale von Produkten rund um „verbessertes“ Wasser.
- Das Verbot von Werbung für Wasser und Wasseraufbereitungsgeräte mit Heilversprechen in einem Grossteil des D-A-CH-Raums umgehen viele Anbieter, indem sie angebliche Wirkungen ihres Produkts nur über Kundenaussagen „kommunizieren“. Das geht über Kundenbewertungen und Testimonials oder Mund-zu-Mund-Propaganda. Hat euch „nur“ jemand von einem tollen Gerät/Produkt/Angebot erzählt? Findet ihr Aussagen zu gesundheitlichen Wirkungen nur von anderen Kunden und nicht vom Hersteller selbst? Dann ist Vorsicht angesagt!
- Wirkungslose Anlagen und Geräte zur „Verbesserung“ von Wasser wie auch fixfertig belebtes Wasser werden häufig zu horrenden Preisen angeboten. Wenn ihr ein fragwürdiges Angebot unter die Lupe nehmen möchtet, vergleicht es einmal mit ähnlichen Produkten ohne „Esoterik“-Label. Fixfertig belebtes Wasser also mit Mineralwasser, als besonders wirksam oder geeignet deklarierte Edelsteine mit den gleichen Steinen ohne solche Attribute beim Mineralienhändler, Elektrokleingeräte mit Haushaltsgeräten aus ähnlichen Bestandteilen, Geräte zum Einbau ins Eigenheim mit „herkömmlichen“ Wasserfiltern für die Trinkwasserzuleitung. Beträgt der Unterschied ein Vielfaches, ist da in der Regel etwas faul.
Wenn euch ein Angebot mit solchen Merkmalen über den Weg läuft, verzichtet guten Gewissens darauf. Dann könnt ihr das Geld für andere Dinge einsetzen, die wirklich gesundheitsfördernd sind: Für einen schönen Familienurlaub zum Beispiel, Mitgliedschaften im Sportverein, Musikstunden, oder einfach für abwechslungsreiches Essen.
Und wenn es dazu schon zu spät ist?
Ihr habt bereits eine Anlage zur Wasserbelebung im Keller? Oder ist der bereits in ein Lager für fixfertig belebtes Wasser umgewandelt?
Zunächst einmal: Ihr seid damit nicht allein. Selbst Betreiber von Schwimmbädern, Spitäler oder eine österreichische Gewerkschaft haben sich schon von solchen Angeboten ködern lassen und eine Menge Geld verbraten. Die können nämlich – ganz offensichtlich – ziemlich verlockend sein und auf den ersten Blick sehr seriös wirken. Bloss zeigt das nicht, wie nützlich die Produkte sind, sondern die Geschäftstüchtigkeit ihrer Anbieter. Und die mag nicht zuletzt daher rühren, dass die Hersteller und Vertreiber selbst an die Wirksamkeit ihrer Produkte glauben (zumindest konnten selbst Anwälte vor Gericht ihnen bislang nichts Gegenteiliges nachweisen).
Besonders wenn Mund-zu-Mund-Propaganda ins Spiel kommt – im schlimmsten Fall innerhalb einer eingeschworenen Community rund um Hersteller und Produkt oder im eigenen Freundeskreis – kann der Einfluss bzw. Druck von „aussen“ auf eure Entscheidungen immens werden. Und wer will es sich schon mit der besten Freundin oder dem netten Forum verscherzen, weil er ein ja soo nützliches Ding kategorisch ablehnt?
Wirksames von Fantasieprodukten zu unterscheiden ist manchmal schwierig
Dazu kommt, dass viele Produkte, Angebote und auch Literatur so seriös und „medizinisch“ aussehen, dass es für Laien echt schwierig sein kann, wirklich Sinnvolles von Fantasieprodukten zu unterscheiden.
Selbst ich als Chemikerin habe einmal mit grossem Interesse in einem populärwissenschaftlichen Buch von Gerald H. Pollack gelesen. Das fiel mir in der Stadtbibliothek auf der Suche nach Literatur über Wasser in die Hände. Das las sich spannend und erst einmal schlüssig – davon abgesehen, dass ich von den dargestellten Theorien und Phänomenen weder in der Schule noch im Studium gehört hatte. Doch was wäre ich für eine Chemikerin, würde ich, ein paar Jahre aus dem Uniumfeld draussen, neue Forschungsergebnisse von vorneherein als unmöglich abstempeln? So fühlte ich mich selbst mit Chemie-Diplom nicht in der Lage, das Buch aus dem Stand sicher einzuordnen. Dabei haben mir erst weitere Recherchen geholfen.
Was tun, wenn das Geld weg ist?
Ist das belebte Wasser erst einmal im Haus und das Geld weg, wenn eure Zweifel überhand nehmen, verbucht das Ganze am besten als Gelegenheit zum Lernen. Wie mein Vater immer sagt: Geld ist den grossen Kummer nicht wert. Und ein Grund, sich zu schämen oder hämische Bemerkungen anhören zu müssen, ist das Ganze meines achtens auch nicht (dahingehend können Anhänger der Skeptiker-Szene im Umgang mit Anhängern solcher Fantasien oft noch eine Menge lernen).
Wichtig ist: Selbstreflexion
Stattdessen fragt euch, was euch wirklich dazu gebracht hat, euch auf belebtes Wasser einzulassen und allenfalls viel Geld dafür auszugeben? Hattet ihr wirklich ein eigenes Bedürfnis danach (z.B. um eine Krankheit zu lindern)? Da belebtes Wasser nachweislich nicht wirkt: Überlegt euch – was fehlt euch wirklich (oder hat gefehlt)? Welche andere(n) Massnahme(n) könnte(n) für eine scheinbare Wirkung des Wassers verantwortlich sein?
Oder habt ihr euch unter dem Einfluss anderer entschieden – Familie, Freunde, (Online-)Community? Wie könnt ihr euch solchen Einflüssen künftig entziehen? Und was bedeuten euch die betreffenden Personen oder Gruppen wirklich? Denn im schlimmsten Fall, wenn ein Druck sich nicht abwehren lässt, kann eine Trennung von ihnen der beste Ausweg sein.
Was ihr in jedem Fall tun könnt
Ob ihr nun selbst in die Falle hineingetappt seid oder nicht, ihr könnt eure Mitmenschen davor bewahren, auf solche sinnlosen Angebote einzugehen.
Dabei erachte ich dies als ganz besonders wichtig:
Nehmt euer Gegenüber ernst. Hinter der Entwicklung unsinniger Glaubensvorstellungen stecken praktisch immer Bedürfnisse oder Ängste, die befriedigt oder gelöst werden wollen, und oft ein erheblicher Einfluss eines äusseren Umfelds (Familie, Freundeskreis, Onlinecommunity,…), der eben diese Bedürfnisse bedient.
Ermuntert eure Mitmenschen, diese Bedürfnisse zu ergründen und sich die unter „Selbstreflexion“ vorgeschlagenen Fragen zu stellen.
Verkneift euch, wenn ihr euch zu den „Skeptikern“ zählt, hämische Bemerkungen oder Bezeichnungen. Zeigt den Betroffenen stattdessen, dass ihr sie als Menschen wertschätzt und gebt ihnen so einen Anreiz, die vermeintliche Zuflucht fragwürdiger Glaubenssätze oder Umfelder zu verlassen.
Und tut das vor allem von Anfang an. Denn je früher Anhänger von Glaubenssätzen, wie jenen um belebtes Wasser, Alternativen zu ihren „Alternativen“ aufgezeigt bekommen, desto höher ist die Chance, sie noch zu erreichen.
Auch wichtig ist: Weitere Verbreitung verhindern
Erinnert euch daran, wie diese fragwürdigen Produkte verbreitet werden. Nämlich über Mund-zu-Mund-Propaganda.
Wenn ihr eure Mitmenschen davor bewahren wollt, auf den Hype um belebtes Wasser (oder andere Fantasie-Produkte) hereinzufallen, dann hört, falls ihr das je getan habt, in jedem Fall auf, sie weiter zu verbreiten und schön zu reden. Oder fangt erst gar nicht damit an. Entfernt oder ändert allfällige positive Bewertungen im Internet, sofern ihr das selbst könnt (Testimonials, die Firmen selbst auf ihren Seiten einfügen, werden diese kaum wieder löschen).
Denn was andere auch behaupten: Belebtes Wasser wirkt nicht über einen Placeboeffekt hinaus.
Besonders lobenswert ist natürlich, wenn ihr euch aktiv für die Aufklärung rund um belebtes Wasser und Co. einsetzt. Erst recht, wenn ihr eine Entscheidungsposition bezüglich der Weiterverbreitung fragwürdiger (und nicht fragwürdiger) Angebote innehabt – sei es auf eurer eigenen Website, in den „grossen“ Medien, einschliesslich Magazinen von Krankenversichereren, Grossverteilern und anderen Branchen, oder gar in der Politik.
Dazu könnt ihr gerne diesen Artikel weiterverbreiten und findet weiteres Material in den Links darin. Zum Beispiel diesen Artikel, in dem Dr. Erich Eder, ein grosser Kritiker des „Grander-Wassers“, beschreibt, wie ihr eure Kritik so formulieren könnt, dass ihr möglichst kein juristisches Vorgehen der Anbieter belebten Wassers riskiert (und wie ihr damit umgehen könnt, falls es doch dazu kommt).
Scheut euch dabei nicht, euren eigenen Fehlentscheid einzugestehen, falls euch einer unterlaufen ist. Hört oder lest darüber hinweg, solltet ihr anfangs abfällige Bemerkungen und Kommentare kassieren. Und trennt euch rigoros von jenen, die sie nicht lassen können. Denn (nicht nur) in meinen Augen zeugt es von wahrer Grösse, seine Ansicht aufgrund neuer Erkenntnisse zu ändern und das auch kundzutun. Und letztendlich kann ein „ich habe das selbst durch, ich weiss, wovon ich rede“ eure Position nur stärken.
Seid ihr belebtem oder sonstwie „verbessertem“ Wasser auch schon begegnet? Wie geht ihr mit Leuten um, die darauf schwören oder/und zu seiner Verbreitung beitragen?