Die IUPAC hat den Nachweis der Existenz der chemischen Elemente 113, 115, 117 und 118 offiziell bestätigt. Diese Nachricht geistert dieser Tage durch die Presse – teilweise in höchst zweifelhafter Qualität. Die grosse Aufmerksamkeit, die diesen exotischen, von Menschenhand geschaffenen Elementen zuteil wird, mag daher rühren, dass solche Nachrichten selten sind: Zuletzt wurde vor 4 Jahren der Nachweis der Elemente 114 und 116 bestätigt. Entdeckt – besser: erschaffen wurden die vier jüngsten chemischen Elemente aber schon vor Jahren!
Das derzeit jüngste Element unseres Periodensystems hat die Ordnungszahl 117 und den vorläufigen Namen Ununseptium (lateinisch für einhundertsiebzehn). Tatsächlich wurde Element Nummer 118 früher nachgewiesen, schlichtweg weil seine Erschaffung einfacher war: Atome mit ungerader Ordnungs- bzw. Protonenzahl sind schwieriger zu erzeugen als Atome mit gerader Ordnungszahl). Nummer 117 wurde erstmals im „Joint Institute for Nuclear Research“ (JNIR) in Dubna, Russland, nachgewiesen und die Ergebnisse im Frühling 2010 veröffentlicht [1]. Das dazu notwendige Experiment ist allerdings von einem derart wahnwitzigen Umfang, dass Dutzende Wissenschaftler in mindestens 6 Forschungseinrichtungen rund um die Welt an seiner Realisierung beteiligt waren.
Und da Wissenschaftler nur das akzeptieren, was sich reproduzieren lässt, hat eine zweite, noch weltumfassendere Forschungsgemeinschaft den Nachweis von Nummer 117 im GSI Helmholtzzentrum für Schwerionenforschung in Darmstadt, Deutschland, wiederholt und die Bestätigung der Ergebnisse aus Dubna 2014 veröffentlicht [2]. Trotzdem nimmt die IUPAC es mit der Überprüfung solcher Ergebnisse sehr genau, sodass sie nun erst, am 30.12.2015, offiziell grünes Licht gegeben hat um 117 und die anderen drei jüngsten Elemente zur endgültigen Benennung freizugeben.
Aber wie erzeugt und detektiert man heutzutage neue Elemente?
Wie Atomkerne entstehen
Atomkerne bestehen aus elektrisch positiv geladenen Protonen und elektrisch ungeladenen Neutronen. Diese beiden Sorten von Kernteilchen sind nahezu gleich schwer, sodass die im Periodensystem verzeichnete Masse eines Atomkerns in der Masseneinheit u nahezu der Anzahl aller seiner Kernteilchen entspricht. Die Anzahl Protonen von Atomen eines Elements ist immer gleich und entspricht der Ordnungszahl im Periodensystem. Ein Wasserstoff-Atom enthält also stets ein Proton: die Ordnungszahl von Wasserstoff ist 1.
Die Anzahl Neutronen ist hingegen nicht festgelegt. Häufig gibt es von einem Element verschiedene Atome mit verschiedenen Neutronenzahlen, wie zum Beispiel der „herkömmliche“ Wasserstoff, auch Protium genannt, dessen Kern aus einem einzigen Proton besteht, und die Kerne von Deuterium (ein Proton und ein Neutron) und Tritium (ein Proton und zwei Neutronen). Diese unterschiedlichen Vertreter eines Elements werden „Isotope“ genannt. Protium, Deuterium und Tritium sind also Isotope des Elements Wasserstoff.
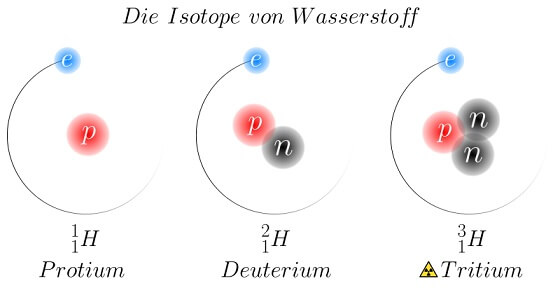
Wasserstoffisotope: Die „Nuklid-Schreibweise“ unter den bildlichen Darstellungen der Kerne gibt das Elementsymbol, links oben die Zahl aller Kernteilchen und links unten die Protonen- bzw. Ordnungszahl an. (By Johannes Schneider (Own work) [CC BY-SA 4.0], via Wikimedia Commons
Wer sich die Darstellung von Atomkernen als Klumpen aus kleinen Kugeln ansieht, mag sich fragen, wie diese Teilchen eigentlich zusammen halten. Schliesslich stossen sich gleiche elektrische Ladungen doch ab, und ungeladene Teilchen sollten der Elektrizitätslehre nach keinen Grund haben einander anzuziehen. Gemäss der Kernphysik haben sie jedoch einen sehr guten Grund dazu: Zwischen Kernteilchen wirkt nämlich die sogenannte „starke Kernkraft“ überaus anziehend, sobald diese erst nah genug beieinander sind. Denn ihrer extrem kurzen Reichweite zum Trotz ist die starke Kernkraft um einiges stärker als die Abstossung zwischen den positiven Ladungen der Protonen in einem Kernklumpen!
Um Atomkerne zu schaffen muss man einzelne Kernteilchen oder kleine Atomkerne also so dicht zusammenbringen, dass die starke Kernkraft wirken kann. Wenn das gelingt, entsteht ein neuer, grösserer Atomkern: Das nennt man Kernfusion.
Bei der Entstehung von leichten Kernen ( also kleineren Atomkernen als jenen des Elements Eisen) durch Kernfusion werden dabei gewaltige Mengen „Kernbindungsenergie“ frei (In Folge dessen ist die Masse des neuen Kerns kleiner als die Summe der Massen seiner einzelnen Bausteine – dieser Umstand ist als Massendefekt bekannt). Diese Energiemenge kann so gewaltig sein, dass sie die Sonne strahlen lässt, einer Wasserstoff-Fusions-Bombe ihre Sprengkraft verleiht und dass ihre friedliche Nutzung in Reaktoren ein Menschheitstraum ist. Dennoch muss niemand fürchten, dass Experimente zur Erschaffung neuer Elemente ihren Schöpfern gleich einer Wasserstoff-Bombe um die Ohren fliegen.
Atomkerne, die schwerer als Eisen sind, sind nämlich – anders als die leichten Kerne – weniger stabil als ihre losen Bausteine. Das heisst, die Erschaffung schwerer Atome „verbraucht“ Energie anstatt sie frei zu setzen, sodass die Masse des neuen Kerns grösser ist als die Summe der Massen seiner Bausteine (umgekehrt wird diese Energie beim radioaktiven Zerfall solch schwerer Kerne wieder frei und macht sich als Bewegungsenergie abgestrahlter α- und β-Teilchen, als γ-Strahlung oder Wärme bemerkbar).
Wie Kernteilchen zusammenfinden
Der simpelste Weg sehr schwere Atomkerne/Elemente zu machen besteht darin, vorhandene Kerne mit Neutronen zu beschiessen, denn wie makroskopische Geschosse sind bewegte Neutronen sehr energiereich und kommen beim Aufprall sehr, sehr nah an ihr Ziel heran. Ausserdem können Neutronen zu Protonen und Elektronen zerfallen (das entspricht einem β-Zerfall: ein aus einem Atomkern abgestrahltes Elektron wird auch β-Teilchen genannt), sodass aus einem Atomkern nach der Eingliederung eines oder mehrerer Neutronen ein nahezu gleich schwerer Kern mit höherer Ordnungszahl entstehen kann!
Das funktioniert im bekannten Universum unter vier Umständen, unter denen genug Neutronen-Geschosse aufgebracht werden, um schwere Kerne aufzubauen: Im Innern eines strahlenden Sterns innerhalb von Jahrmillionen, in einer Supernova, im Feuer einer Wasserstoff-Fusions-Bombe, und in Atom-Reaktoren. Aber wie man es dreht und wendet: Mit Neutronenbeschuss kommt man nur bis zum Element Fermium mit der Ordnungszahl 100.
Danach nimmt ein Problem überhand: Alle Atomkerne mit 84 oder mehr Protonen sind radioaktiv, d.h. sie zerfallen früher oder später durch Abgabe von α- oder β-Teilchen oder spalten sich ganz von selbst in zwei oder mehr grössere Bruchstücke. Und Elemente mit mehr als 100 Protonen zerfallen schneller, als dass sie durch Aufnahme einzelner Neutronen aufgebaut werden könnten.
Deshalb muss man die Atomkerne neuer Elemente in einem Schritt aus zwei grösseren Teilkernen zusammenschmelzen: Das kleinere Teilstück (ein Atomkern ohne Elektronenhülle ist das Extrem eines Ions, weshalb man diese Teilchen Schwer-Ionen nennt) wird beschleunigt und auf das grössere Teilstück geschossen. Wenn dabei ein genauer Treffer gelandet wird, entsteht aus beiden Teilen ein neuer Kern. Da zu dieser Form der Verschmelzung keine unfassbare Sternenhitze nötig ist, nennt man das Verfahren „kalte“ Schwerionenfusion. Ein dabei entstehender neuer Kern besteht in der Regel nur wenige Sekundenbruchteile, ehe er entweder α-Teilchen abgibt oder sich spontan spaltet.
Ziel solcher Experimente ist die Schaffung neuer Kerne, die α-Teilchen abgeben anstatt sich spontan zu spalten. Denn die Energie dieser α-Teilchen lässt sich vorab anhand von Kern-Modellen sehr genau berechnen, sodass die Registrierung von α-Teilchen mit der passenden Energie als Nachweis für die zeitweilige Existenz der neuen Kerne verwendet werden kann.
Die meisten neuen Kerne geben jedoch der spontanen Spaltung den Vorzug, weil sie bei der Schwerionenfusion etwas mehr Energie erhalten, als für die Verschmelzung notwendig ist. Mit viel Glück können sie dieses „Mehr“ an Energie jedoch rechtzeitig loswerden, indem sie einzelne Neutronen ab“strahlen“, bis der α-Zerfall schliesslich einsetzt. Allerdings funktioniert dieses „Abdampfen“ von Neutronen ziemlich selten: Schon bei der Schwerionenfusion von zwei Teilkernen zum Element Bohrium (Ordnungszahl 107) gelingt dies nur bei einem von 1000 Kernen [3]!
Was man für die Erschaffung eines neuen Elements braucht
Für ein Experiment zur Erschaffung eines neuen Elements braucht man also ein Zielmaterial (englisch „target“) aus Atomen eines ausreichend schweren Ausgangselements, passende schnelle Schwerionen und einen schnellen aber hochempfindlichen Detektor, der einzelne α-Teilchen aus dem Teilchensalat eines nuklearen Trommelfeuers filtern und registrieren kann.
Für den Nachweis von Element 117 wurden Atome des Elements Berkelium (Ordnungszahl 97) verwendet. Berkelium kann demnach in speziellen Atomreaktoren durch Beschuss mit Neutronen entstehen, wie im Hochfluss-Isotopen-Reaktor des Oak Ridge National Laboratory (ORNL) in Tennessee, USA. In diesem Reaktor werden Atome der Elemente Curium (Ordnungszahl 96) und Americium (Ordnungszahl 95) etwa 250 Tage lang „gebrütet“, bis aus ihnen Atome des Berkelium-Isotops mit der Masse 249 entstanden ist. Dieses Isotop ist so stabil (seine Halbwertszeit beträgt 330 Tage), dass man die Atome isolieren, von Tennessee nach Russland schaffen, zu „Targets“ verarbeiten und in Experimenten verwenden kann, bevor sie wieder zerfallen sind.
Da allerdings maschinengewehrgleicher Beschuss mit Schwerionen jedes Material alsbald in atomare Trümmer zerlegt, wurden Folien mit Berkelium auf ein Rad montiert, das sich später im Schwerionenstrahl drehte. So konnte das Trommelfeuer und damit seine Zerstörungskraft bei durchgehendem Beschuss auf mehrere Folien verteilt werden.

Berkelium-Target-Rad, wie es im Labor der GSI Verwendung findet. Foto: Christoph Düllmann/GSI Helmholtzzentrum für Schwerionenforschung GmbH
Die Schwerionen-Geschosse waren Kerne des Calcium-Isotops der Masse 48. Die Herstellung solcher Ionen ist weniger kompliziert – um sie auf Touren zu bringen, braucht man jedoch einen Teilchenbeschleuniger für schwere Teilchen: Ein solcher ist das Schwerionen-Zyklotron U-400 im JINR Dubna. Der Ionenfluss, der damit auf das Target losgelassen wurde, betrug 7*1012 (7 Billionen) Ionen pro Sekunde!
Wer wissen möchte, wie so ein Beschleuniger aussieht, kann einen virtuellen Spaziergang durch das Beschleuniger-Labor in Dubna machen. Der eigentliche Teilchenbeschleuniger U-400 ist der flache gelbe Zylinder (sein Durchmesser beträgt 4 Meter), der in dem grossen blassblauen Kasten steckt. Die Ionen werden darin auf einer engen Spiralbahn beschleunigt und fliegen schliesslich durch die speichenartigen Fortsätze ihrem Ziel entgegen.
Das Experiment wurde schliesslich so aufgebaut, dass neu entstehende Kerne beim Aufprall der Schwerionen aus der Target-Folie geschleudert und durch luftleere Leitungen in den α-Teilchen-Detektor aus hochempfindlichen Halbleiter-Bausteinen sausen konnten, noch während sie aus dem sie begleitenden Trümmerstrom aussortiert wurden. Um das Sortieren zu erleichtern, wurde zudem der Schwerionenbeschuss nach jedem Signal, das auf die Freisetzung eines gewünschten Kerns aus dem Target hindeutete, für drei Minuten eingestellt.

Der Transactiniden-Separator TASCA: Die hochmoderne Teilchen-Sortiermaschine der GSI. Verschiedene Teilchen werden im Flug durch Magnetfelder auf verschiedene Bahnen gelenkt. Damit wurde auch die Erschaffung von Element 117 erfolgreich wiederholt. (Foto: Gaby Otto/GSI Helmholtzzentrum für Schwerionenforschung GmbH)
Wie die Entdeckung eines neuen Elements abläuft
Die Bestrahlung eines Targets mit Schwerionen in diesem Experiment dauerte schliesslich 70 Tage mit insgesamt 79 Stunden Feuerpause. In dieser Zeit wurde bei ein vom Zerfall eines Atoms von Element 117 mit der Masse 293 stammendes α-Teilchen mit der berechneten Energie von 39MeV fünfmal beobachtet. In einem zweiten Experiment, das ebenfalls 70 Tage dauerte, wurde mit leicht veränderten Energie-Werten gearbeitet und einmal der Zerfall eines Atoms von 117 mit der Masse 294 beobachtet.
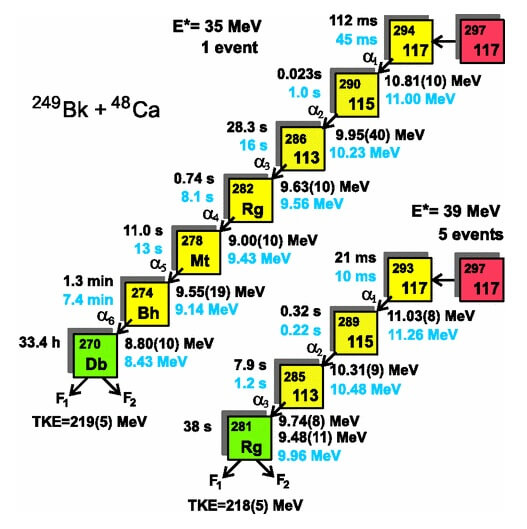
Zerfallsreihe der beiden registrierten Isotope von Element 117: Durch Schwerionenfusion entsteht das Isotop mit der Masse 297 (rot), welches 3 bzw. 4 Neutronen abgeben kann. Anschliessend verliert das jeweilige 117-Isotop mit jedem abgestrahlten Alphateilchen 2 Protonen und 2 Neutronen (gelbe Kette), bis ein Dubnium- bzw. Röntgenium-Atom (grün) übrig bleibt, das sich spontan in zwei Teile (F1 und F2) spaltet. Die Übereinstimmung zwischen den berechneten (schwarz) und gemessenen (hellblau) Abfolgen von Zerfallszeiten und Teilchenenergien dienen als Beweis dafür, dass die dargestellten Kernreaktionen – angefangen mit Element 117! – so stattgefunden haben. (Quelle: Oganessian et al.,2010 [1])
Nach der Ingangsetzung des Experiments haben die Wissenschaftler also jeweils 70 Tage in gespannter Erwartung ausgeharrt und auf ein Signal des Computers gehofft, das den Zerfall von Element 117 anzeigte. In 140 Tagen Beschuss rund um die Uhr ist das insgesamt sechsmal passiert! Damit haben die Wissenschaftler auf diese Weise die kurzzeitige Existenz von insgesamt bloss 6 Atomen von Element 117 nachweisen können! Neue Elemente finden erfordert also wochenlange, geduldige Warterei.
Die Veröffentlichung dieser Ergebnisse vom 7. April 2010 hat 33 Autoren, angeführt von Yu. Ts. Oganessian, die in mindestens sechs verschiedenen Forschungsinstituten an diesem Experiment und seinen Vorbereitungen mitgearbeitet haben.
Eine vergleichbare internationale Zusammenarbeit von 72 Wissenschaftlern in 16 Forschungszentren rund um den Globus führte bis Mai 2014 zu einem zweiten Nachweis von Element 117 unter ähnlichen Bedingungen am GSI Helmholtzzentrum für Schwerionenforschung in Darmstadt, welcher für die offizielle Anerkennung der Entdeckung eines neuen Elements notwendig ist.
Warum zur Hölle macht man sowas?
Weil man es kann. Zudem: Die Halbwertszeit von Element 117 (14 ms für 293117 bzw. 78 ms für 294117) ist wie die seiner Nachbarn im Periodensystem so kurz, dass es höchst aufwändig ist, die Eigenschaften seiner Atome oder gar des Stoffs mit derzeit verfügbaren Mitteln eingehender zu untersuchen. Im Blog der GSI Darmstadt kann man nachlesen, wie es dabei zu und her geht: Element 114: Gas oder Metall?
Aber der Nachweis solcher Elemente bestätigt die Genauigkeit des Atomkern-Modells, anhand dessen neben den Energien abgestrahlter α-Teilchen viele weitere Eigenschaften unbekannter Elemente vorausberechnet werden können.
Diese Fähigkeit der Vorhersage von Eigenschaften ist übrigens alles andere als selbstverständlich. Sie erst macht die Modelle der Kernphysik, wie auch der Chemie zu einem unglaublich mächtigen und faszinierenden Instrument, mit welchem nicht nur Atome berechnet, sondern – und ganz besonders – auch Moleküle und Stoffe am Reissbrett entworfen und geschaffen werden können!
Und die Berechnungen zur Vorhersage der nächsten unbekannten Elemente lassen darauf schliessen, dass es im Bereich der Ordnungszahlen 114 bis 126 Elemente gibt, deren Atome ausreichend stabil sind, um sie – zumindest während ihres Vorbeiflugs – eingehender untersuchen und weitere Vorhersagen bestätigen zu können.
Die Kernphysiker ordnen schliesslich alle bekannten (und vorhergesagten) Atome in einer Tabelle an, die Nuklidkarte genannt wird. Diese „Karte“ zeigt stabile Atome in Form eines „Kontinents“ in einem Meer aus Einträgen für instabile Kerne an. Die Anhäufung der vermuteten Stabileren unter den Atomen der unbekannten Elemente wird deshalb häufig als „Insel der Stabilität“ abseits des Kontinents im „Meer der Instabilität“ bezeichnet.
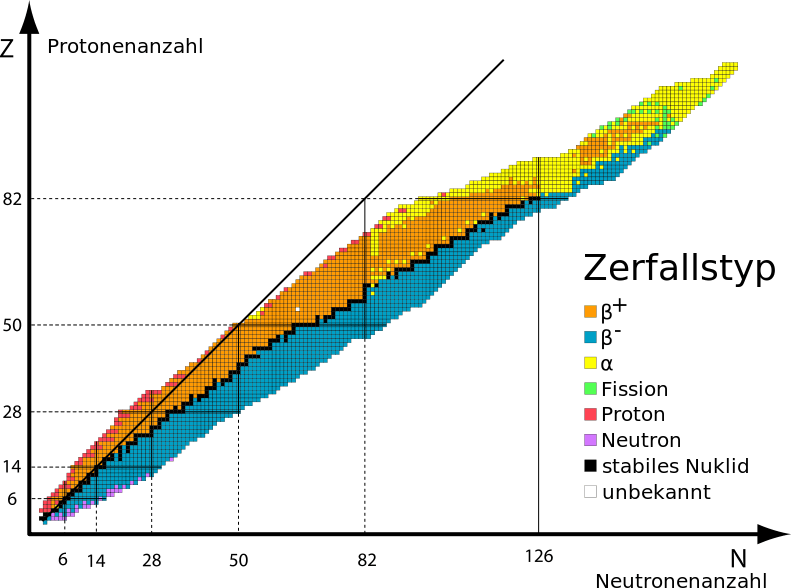
Nuklidkarte nach Segré: Man erkennt den langgestreckten „Kontinent“ aus stabilen, schwarz markierten Atomsorten (Nukliden) im Meer der instabilen, d.h. radioaktiven Nuklide. Die Liste unter „Zerfallstyp“ gibt an, welche Teilchen die zerfallenden Atome abgeben. „Fission“ ist der Fachbegriff für die Kernspaltung (hier: spontane Spaltung). Die Insel der Stabilität wird irgendwo oben rechts jenseits der gelben Spitze vermutet. (By Matt [CC BY-SA 3.0 or GFDL], via Wikimedia Commons)
Und die Kernphysiker suchen in diesem „Meer“ gleich einstigen Entdeckern auf den Weltmeeren nach ihrer legendären Insel. Wenngleich Kernphysiker dabei keine lukrativen atomaren Handelsrouten zwischen den Kernen entdecken mögen, hoffen sie gleich manch einem Weltumsegler, ihre Theorien vom Aufbau der Welt beweisen zu können. Ihr nächstes Ziel, Element Nummer 120, haben sie bis dato noch nicht erreicht.
Gemäss den Regeln der IUPAC dürfen chemische Elemente nach einer ihrer Eigenschaften, einem Mineral, einem/r bedeutenden Wissenschaftler/in oder einem Ort benannt werden. Welchen Namen würdet ihr Nummer 117 (und den drei anderen) geben?
Und wer noch mehr lesen möchte: Das Buch „Moderne Alchemie – Die Jagd nach den schwersten Elementen“ (Literatur [3]), verfasst von Wissenschaftlern der GSI in Darmstadt, erzählt verständlich und – wie ich finde – äusserst spannend von der Physik superschwerer Atomkerne und ihrer Erforschung.
Literatur:
[1] Oganessian,Yu.Ts. et al.(2010). Synthesis of a New Element with Atomic Number Z = 117. In: Physical Review Letters, 104, 9.April 2010, 142502.
[2] J. Khuyagbaatar et al. (2014). 48Ca+249Bk Fusion Reaction Leading to Element Z=117: Long-Lived α-Decaying 270Db and Discovery of 266Lr. In: Physical Review Letters, 112, 1.Mai 2014, 172501.
[3] Münzenberg , G., Schädel, M. (1996). Moderne Alchemie – Die Jagd nach den schwersten Elementen. Wiesbaden: Vieweg (Facetten).










