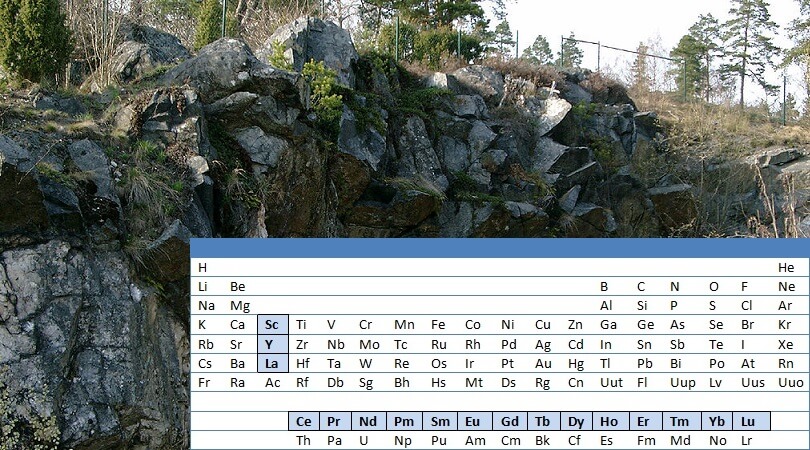
Was sind „seltene Erden“? Warum ist dieser Name eigentlich irreführend? Was haben die chemischen Elemente, die diese Bezeichnung tragen, gemeinsam? Und warum haben sie gerade in den letzten Jahren häufig Schlagzeilen gemacht?
Das Artikelbild zeigt die aufgelassene Grube Ytterby heute (By Svens Welt (Own work) [CC BY-SA 3.0], via Wikimedia Commons). Traditionell statten alle Empfänger eines Nobelpreises dieser Fundgrube einzigartiger chemischer Elemente einen Besuch ab. Denn vor über 200 Jahren begann dort die Geschichte der seltenen Erden.
Ein Ausflug in die Geschichte: Als die seltenen Erden noch selten waren
Ytterby, Schweden, 1787. Leutnant Carl Axel Arrhenius streift über die Abraumhalden der Grube nahe des kleinen Dorfes auf einer Insel vor Stockholm. Schon seit dem sechzehnten Jahrhundert hat man hier Quarz für die Eisenhütten der Umgebung abgebaut, und neuerdings gewinnt man ausserdem Feldspat für die Porzellan- und Glasindustrie. Arrhenius interessiert sich jedoch nicht für diese beiden gar zu häufigen Mineralien, sondern für das, was die Minenarbeiter unweigerlich mit ihnen zu Tage fördern und als unbrauchbar auf den Halden entsorgen. Für den Leutnant ist die Stationierung im nahen Vaxholm ein Glücksfall, gibt sie ihm doch die Gelegenheit, hier in Ytterby seinem grossen Hobby, der Geologie, nachzugehen und nach Mineralien zu suchen.
Die Abraumhalden von Ytterby haben schon manch interessantes Fundstück für ihn bereit gehalten, sodass es Arrhenius immer wieder hier hinaus zieht. Doch was er nun in der Hand hält, ist wahrhaft aussergewöhnlich. Der schwarze Stein, ein raues Felsbruchstück, ist bemerkenswert schwer, und Arrhenius‘ Sammlerinstinkt lässt ihn ahnen: Das ist etwas ganz besonderes.

Gadolinit: Grosser Einkristall (8.2 x 7.1 x 5.2 cm), Tuftane-Steinbruch, Frikstad, Norwegen (by Rob Lavinsky, iRocks.com – CC-BY-SA-3.0 [CC BY-SA 3.0], via Wikimedia Commons)
Welch ein Glück, dass er mit einigen der berühmtesten skandinavischen Chemiker seiner Zeit bekannt ist, und diese sich der Untersuchung seines seltsamen Fundstücks annehmen. Professor Johan Gadolin von der Universität von Åbo gelingt schliesslich eine vielversprechende Analyse: Rund 38% des schwarzen Minerals bestehen demnach aus einer ganz neuartigen „Erde“, welche Gadolin aus seinen Proben aus Ytterby isolieren kann. Als „Erden“ bezeichnen die Chemiker zu dieser Zeit die Oxide der Metalle – die Begriff „Oxid“ ist wesentlich jüngeren Datums.
Gadolins Erde erhält nach ihrem Herkunftsort den Namen „Yttererde“, und der Chemiker erkennt, dass darin ein neues Element enthalten ist. Später erhält dieses Element – wiederum nach dem Ort seiner ersten Entdeckung – den Namen Yttrium, während das schwarze Mineral zu Ehren seines Untersuchers „Gadolinit“ genannt wird.
Die eigentliche Überraschung, welche dieses Mineral in sich birgt, wird jedoch erst im Laufe eines Jahrhunderts voller Arbeit vieler Chemiker offenbar: Die Yttererde besteht nicht, wie man annehmen mag, aus reinem Yttriumoxid, sondern lässt sich in mehrere verschiedene Oxide auftrennen! Und mit vielen ähnlichen neuen „Erden“ verhält es sich ebenso.
Heute wird die chemische Formel des Gadolinits, welchem die Yttererde entstammt, mit (Ce,La,Nd,Y)2FeBe2Si2O10 angegeben. Damit enthält das Mineral nicht bloss eines, sondern gleich vier Elemente, welche Leutnant Arrhenius und Professor Gadolin ihrerzeit nicht bekannt waren: Yttrium (Y), Cer (Ce), Lanthan (La) und Neodym (Nd). Und die Aufzählung ihrer Symbole innerhalb der runden Klammern deutet an, warum Gadolin sie nicht gleich alle entdeckt hat: Diese Elemente sind sich chemisch so ähnlich, dass sie in natürlichen Kristallen (d.h. Mineralien) stets bunt gemischt vorkommen und mit den Methoden des späten 18. Jahrhunderts kaum zu trennen waren.
Reiche Erzlagerstätten dieser und weiterer einander täuschend ähnlicher Elemente, wie die Mine in Ytterby, sind nicht besonders häufig. So waren wohl auch die Oxide dieser Elemente anfänglich nicht nur neu und merkwürdig, sondern in der Welt der Chemiker und Mineralogen überdies selten, was den Elementen und ihren Verbindungen ihren bis heute verbliebenen gemeinsamen Namen eingebracht haben wird: „Seltene Erden“.
Ein Steckbrief der „seltenen Erden“
Seltene Erden sind:
- nach heutiger Auffassung die Elemente Scandium, Yttrium, Lanthan und die 14 auf Lanthan folgenden Elemente, die auch „Lanthanoiden“ genannt werden: Cer, Praseodym, Neodym, Promethium, Samarium, Europium, Gadolinium, Terbium, Dysprosium, Holmium, Erbium, Thulium, Ytterbium und Lutetium:
Scandium, Yttrium und Lanthan sind sogenannte Übergangsmetalle, die im Periodensystem untereinander stehen. Das bedeutet, ihre Elektronenhüllen sind analog aufgebaut, was allein schon ihre chemische Ähnlichkeit erklärt. Die 14 Lanthanoiden werden (gemeinsam mit den Actinoiden) häufig in einer separaten Zeile unterhalb des Periodensystems aufgelistet, damit das Ganze vernünftig auf ein Blatt Papier passt. Eigentlich gehören sie nämlich in die sechste Periode zwischen Lanthan und Hafnium.
- auf der Erde gar nicht so selten:
Grössere Seltenerd-Erzlagerstätten sind zwar selten, aber kleine Mengen der Elemente sind über eine Vielzahl von Mineralien und Erzen weit verteilt. So findet man das häufigste Seltenerd-Element Cer auf der Erde häufiger als Kupfer, während das seltenste, Thulium, noch häufiger ist als Silber.
- einander sehr ähnliche Metalle:
Die elementaren Seltenerdmetalle sind silberweiss, metallglänzend und formbar – typische Metalle eben. Darüber hinaus sind sie in sehr ähnlicher Weise unedel und sehr reaktiv. Alle Seltenerdmetalle sind hochentzündlich, manche Lanthanoiden neigen sogar zur Selbstentzündung an der Luft. Deshalb werden viele Seltenerdmetalle für industrielle Zwecke häufiger in Form stabilerer chemischer Verbindungen verkauft anstatt als reines Metall.

Die Lanthanoiden (ausser Promethium) als reine Metalle by Tomihahndorf at the German language Wikipedia [GFDL or CC-BY-SA-3.0], via Wikimedia Commons
- Unverzichtbare Bestandteile der modernen Technik:
Ob als Bestandteil von Nickel-Metallhydrid-(NiMH)-Akkus, in „Supermagneten“, z.B. in Windkraftanlagen und Lasern, Computern, Bildschirmen und Energiesparlampen als Katalysatoren oder gar als Kontrastmittel in der Medizin: In kaum einem Bereich des modernen, technischen Lebens begegnet man den Seltenerd-Metallen nicht. Deshalb sind sie insbesondere für die Industriestaaten als Rohstoffe so unverzichtbar.
- nicht radioaktiv:
Mit einer Ausnahme: Das Lanthanoid Promethium kommt nur in Form des β-strahlenden Pm-147 mit einer Halbwertszeit von rund 2,6 Jahren in der Natur vor – in kleinsten Mengen als Zerfallsprodukt von Uran in dessen Erzen. Das langlebigste (künstlich erzeugte) Promethium-Isotop ist Pm-145 mit einer Halbwertszeit von 17,7 Jahren. Somit sind alle Promethium-Isotope, die vielleicht einmal in der Materie, welche die Erde formen sollte, enthalten waren, in den viereinhalb Milliarden Jahren Erdgeschichte längst zerfallen.
- Im Vergleich zu vielen bekannten Schwermetallen nur wenig bis gar nicht giftig:
Viele weitere Bestandteile der Erze (darunter finden sich nicht selten sogar radioaktive Elemente wie Uran und Thorium!), aus welchen sie gewonnen werden, hingegen schon. Deshalb ist der beim Abbau von Seltenerd-Metallen zurückbleibende Schlamm Umwelt und Gesundheit zuliebe sicher zu verwahren oder zu entsorgen.
- Im Internet für jedermann erhältlich:
In den gängigen Online-Auktionshäusern werden immer wieder Seltenerd-Metalle angeboten. Aber Achtung: Längst nicht alles, was dort als „Seltenerd-Metall“ oder bezeichnet wird, ist auch ein solches – dazu zählen nur die oben genannten bzw. in der folgenden Tabelle aufgezählten Elemente!. In der Regel sind reine Seltenerd-Metalle unter einer reaktionsträgen Atmosphäre (meist Argon) in Glasphiolen eingeschlossen, damit sie nicht mit ihrer Umgebung reagieren können. Ein hochwertiger Schaukasten mit allen Lanthanoiden ausser Promethium ist meist für gute 350 Euro bzw. knapp 400 Franken zu haben.
| Element | Element-symbol | Bedeutung des Namens | Verwendung in der Technik (Beispiele) |
| Scandium | Sc | lat.: Scandia für Skandinavien, wo das erste Erz entdeckt wurde | Stadionbeleuchtung, Brennstoffzellen, Laser |
| Yttrium | Y | nach Ytterby, dem Ort seines Erstfundes | Leuchtdioden, Flachbildschirme, Laser |
| Lanthan | La | griech.: lanthanein = versteckt sein | Ni-MH-Akkus, Katalysatoren |
| Cer | Ce | nach dem zur gleichen Zeit entdeckten Zwergplaneten Ceres | Abgas-Katalysatoren, UV-Schutzgläser |
| Praseodym | Pr | griech.: prásinos = lauchgrün, didymos = doppelt : der lauchgrüne Zwilling | Dauermagnete, Elektromotoren, Glasfarbstoff |
| Neodym | Nd | griech.: neos = neu, didymos = doppelt : der neue Zwilling | Dauermagnete (z.B. in Windkraftanlagen), CD-Spieler |
| Promethium | Pm | nach Prometheus, einer Figur der griechischen Mythologie | Leuchtziffern, Wärmebatterien in Raumfahrzeugen (da radioaktiv!) |
| Samarium | Sm | nach dem Mineral Samarskit, in welchem es erstmals nachgewiesen wurde | Dauermagnete in elektronischen Kleingeräten, auch Raumfahrt |
| Europium | Eu | nach dem Kontinent Europa | roter Leuchtfarbstoff: Leuchtdioden, Plasmabildschirme, Energiesparlampen |
| Gadolinium | Gd | nach dem Mineral Gadolinit | Kontrastmittel für die Kernspin- tomographie, grüner Leuchtfarbstoff in Radarschirmen |
| Terbium | Tb | nach Ytterby, dem Ort des Erstfundes einer seltenen Erde | Dauermagnete, Sonartechnik |
| Dysprosium | Dy | griech.: dysprosios = unzugänglich | Dotierung von Kondensatoren, Dosimeter, Halogenlampen |
| Holmium | Ho | lat.: Holmia für Stockholm, die Hauptstadt Schwedens | Laser |
| Erbium | Er | nach Ytterby, dem Ort des Erstfundes einer seltenen Erde | Laser, Glasfaserkabel bzw. -verstärker |
| Thulium | Tm | nach Thule, der Bezeichnung für Skandinavien in der klassischen Antike | Dotierung in der Röntgentechnik, Gamma-Strahlenquelle für die Werkstoff- prüfung |
| Ytterbium | Yb | nach Ytterby, dem Ort des Erstfundes einer seltenen Erde | Kunststoff-Zahnfüllungen, Laser |
| Lutetium | Lu | lat.: Lutetia für Paris, die Hauptstadt Frankreichs | Beta-Strahlenquelle: Positronen-Emissions-Tomografie |
Warum sich die seltenen Erden chemisch so sehr ähneln
Die Seltenerd-Metalle gleichen einander in ihrer Chemie derart, dass selbst die Natur sie ständig miteinander verwechselt: Ein Seltenerd-Erz enthält stets mehrere verschiedene Metalle, deren Ionen ihre Plätze im Kristall wechselweise einnehmen, als gehörten sie allesamt zur selben Ionensorte. Wenn Chemiker versuchen, für solch einen Kristall eine chemische Formel aufzustellen, kommt so etwas herum wie für das schon erwähnte Mineral Gadolinit: (Ce,La,Nd,Y)2FeBe2Si2O10 . Es handelt sich dabei um ein Silikat, also ein Salz einer Kieselsäure, welches neben einem Eisen- und zwei Beryllium-Ionen zusätzlich zwei Seltenerdmetall-Ionen je Formeleinheit enthält. Innerhalb der runden Klammern ist die Auswahl derjenigen Metalle angegeben, aus welcher diese beiden Ionen stammen: Cer, Lanthan, Neodym und Yttrium. Welche beiden dieser Ionen man in einem beliebigen Ausschnitt des Kristalls, für welchen die Formel steht, jeweils antrifft, ist freilich dem Zufall überlassen.
Doch warum sind sich die Seltenerd-Metalle chemisch so ähnlich? Die Chemie eines Atoms, also seine Neigung zu Reaktionen sowie seine „Passform“ bei der Entstehung eines Ionenkristalls, wird vom Aufbau seiner Elektronenhülle bestimmt. Und der ist normalerweise von Element zu Element verschieden – einzig die Elemente, die im Periodensystem untereinander stehen (wie Scandium, Yttrium und Lanthan), ähneln sich ein Stück weit, da sich ihre Elektronenhüllen nur in der Anzahl besetzter Energieniveaus („Etagen“ im Elektronenhüllen-Haus) unterscheiden, nicht aber in der Besetzung des massgeblichen äussersten Niveaus.
Die Lanthanoiden unter den seltenen Erden haben alle miteinander eine einzigartige Stellung im Periodensystem inne, da sie die ersten Elemente mit Elektronen in einem zusätzlichen „Zwischengeschoss“ sind, dessen Elektronen-„Wohnungen“ die Chemiker als f-Orbitale bezeichnen. Das besetzte f-Zwischengeschoss der Lanthanoiden gehört dabei rein formal zur vierten „Etage“ des Elektronenhülle, obwohl es in der sechsten Zeile (Periode) des Periodensystems auftauchen und dementsprechend auch erst nach dem ersten Orbital der sechsten „Etage“ aufgefüllt werden.
Gemäss den Spielregeln der Chemie sind jedoch die Elektronen der äussersten Schale (die auch als „Valenzelektronen“ bezeichnet werden) für das Verhalten eines Atoms entscheidend – bei den Lanthanoiden also die drei Elektronen, welche den ersten drei Positionen in der sechsten Periode des Periodensystems entsprechen. Wie viele Elektronen darüber hinaus im f-Zwischengeschoss sind, ist hingegen ziemlich egal. So wird es niemanden wundern, dass alle Seltenerd-Metalle dreifach positiv geladene Ionen bilden, indem sie ihre drei Valenzelektronen abgeben und damit ihre Aussen-Etage vollkommen entleeren (einige bilden darüber hinaus auch zwei- oder vierfach positiv geladene Ionen, da sie ihre Elektronen noch anderweitig „energetisch günstig“ zu sortieren wissen).
Dieser besondere Aufbau der Elektronenhüllen der Lanthanoide hat noch einen weiteren einzigartigen Effekt zur Folge: Normalerweise sind Ionen der Elemente umso grösser, je mehr Elektronen in ihrer Hülle „Wohnungen“ bzw. Orbitale besetzen. Logisch, denn je mehr bewohnte Wohnungen man haben will, desto höher wird man das Haus bauen müssen.
Bei den Lanthanoiden wirkt sich der Einzug der Elektronen in die Orbitale des f-Zwischengeschosses jedoch nicht auf die Höhe des Hauses aus – gehört dieses Zwischengeschoss doch zur vierten Etage und nicht zur sechsten. Da mit der wachsenden Anzahl Elektronen jedoch auch die positive Ladung des Atomkerns zunimmt, steigt auch die Anziehungskraft, die der Kern auf seine Elektronenhülle ausübt – ohne dass diese durch zusätzliche Wohnungen und Etagen dicker würde. Und diese Anziehungskraft macht sich so stark bemerkbar, dass die Ionen der Lanthanoiden von links nach rechts im Periodensystem tatsächlich kleiner werden, anstatt wie bei allen anderen Elementen grösser! Dieser Effekt, den die Chemiker „Lanthanoidenkontraktion“ nennen, ist so stark, dass ein Dysprosium-Ion (das neunte Element in der Reihe der Lanthanoiden) ebenso klein ist wie ein Yttrium-Ion, dessen äusserste besetzte Etage die fünfte anstatt der sechsten ist!
Warum in den letzten Jahren so ein Aufstand um seltene Erden gemacht wurde
Ohne die seltenen Erden könnte es unsere High-Tech-Welt, wie sie zur Zeit aussieht, nicht geben. Das zeigt allein schon die oben gelistete Auswahl an technischen Anwendungen dieser einzigartigen Metalle. Ihre Gewinnung ist jedoch mit grossem Aufwand und Risiken für die Umwelt verbunden. Wohl deshalb leistet zu Beginn des 21. Jahrhunderts China weit über 90% der weltweiten Förderung der seltenen Erden – nennt es doch die weltweit grössten zusammenhängenden Vorkommen an Seltenerd-Erzen sein Eigen, welche etwa 30% der weltweiten Reserven ausmachen.
All jene Industriestaaten, die sich die Hände nicht in dieser Weise schmutzig machen wollen, sind damit weitestgehend auf die Einfuhr von seltenen Erden aus China angewiesen. Als die Chinesen 2010 entschieden, die Ausfuhr ihrer seltenen Erden zu beschränken, gerieten ihre Abnehmer somit gehörig ins Schwitzen – denn alternative Quellen waren auf die Schnelle nicht zur Hand. Die Begründung Chinas, die Beschränkung der Umwelt zuliebe einzuführen (Warum sollten wir uns für euch andere die Hände bzw. die Umwelt schmutzig machen?), erschien der Weltöffentlichkeit zudem als reichlich wenig glaubwürdig.
So schien es nur noch zwei Möglichkeiten zu geben einen Engpass in Sachen seltene Erden zu vermeiden: Die Ansiedelung von Hightech-Produktionsfirmen in China, um anstelle der Seltenerd-Erze die fertigen Produkte aus China auszuführen, oder eine Beschwerde bei der Welthandelsorganisation WTO – denn die Ausnutzung eines Rohstoff-Monopols um einheimischen Firmen Wettbewerbsvorteile zu verschaffen ist gemäss den Spielregeln der Weltwirtschaft nicht erlaubt.
Nachdem jene westlichen Firmen, die sich für eine Ansiedelung in China entschieden, auch dort von Benachteiligungen gegenüber den einheimischen Konkurrenten berichteten und eine geplante Erhöhung der Ausfuhrzölle für seltene Erden die Lage noch mehr zu verschärfen drohte, zogen die USA, gefolgt von der EU und Japan, am 13. März 2012 schliesslich vor das Gericht der WTO – und erhielten Recht. Doch obwohl dieser Schiedsspruch schon im Jahr 2013 erfolgte, sträubten die Chinesen sich noch bis Anfang 2015, ehe sie die Ausfuhr der seltenen Erden endgültig freigaben.
Die Ironie dabei: Tatsächlich wurde die Beschränkung der Ausfuhr von seltenen Erden auf rund 31.000 Tonnen pro Jahr nie ausgeschöpft – im Jahr 2013 wurden laut der FAZ gerade einmal 22.493 Tonnen exportiert, bis November 2014 waren es 24.886 Tonnen. Hat China die Ausfuhrbeschränkung also letztlich aufgehoben, weil sie keinen Nutzen mehr hatte?
Wenn der ganze Zwist um die chinesischen seltenen Erden für den Rest der Welt einen Nutzen hatte, dann wohl jenen, dass er diese wichtigen, der Allgemeinheit aber eher unbekannten Elemente populär machte und zum Nachdenken über andere Gewinnungsmöglichkeiten – vor allem durch Recycling von „High-Tech-Abfällen“ – angeregt hat und anregt.
Und welche seltene(n) Erde(n) sind euch in eurem Alltag schon begegnet?
Literatur:
[1] L.F.Trueb (2005). Die chemischen Elemente – Ein Streifzug durch das Periodensystem. Stuttgart: S.Hirzel Verlag
[2] Der einmal wirklich gute Wikipedia-Artikel zu den Seltenen Erden