Die Weihnachtszeit ist auch die Zeit von Festtagsmenu und fein herausgeputzter Tafel. Aber gerade wer die eher selten eindeckt, steht mitunter vor einem ungeliebten Haufen Arbeit: Das Tafelsilber ist schon wieder angelaufen – und auch der Silberschmuck zum Festtagsoutfit glänzt nicht mehr. Also ist Putzen und Polieren angesagt…es sei denn, man versteht ein wenig von Chemie.

Weitere Beiträge zum Thema des Tages „Fein herausgeputzt“ findet ihr auf
www.marie-theres-schindler.de
http://cosmic-blue.jimdofree.com
https://das-leben-ist-schoen.net
Warum läuft Silber an?
Landläufig kennt man Silber eigentlich als Edelmetall – also als eines jener Metalle, die als so reaktionsträge gelten, dass sie auch an der Luft mehr oder weniger blank bleiben. „Reaktionsträge“ meint dabei „schwer bis gar nicht zu oxidieren“. Und für das Oxidieren an der Luft ist in der Regel der darin enthaltene Sauerstoff verantwortlich. Der kann dem Silber aber gar nichts, wenn er alleine ist. Anders sieht es aber aus, wenn der Sauerstoff Unterstützung durch seinen grossen Bruder hat: Den Schwefel.
Schwefel: Der anrüchige Bruder des Sauerstoffs
Der steht im Periodensystem der Elemente direkt unter dem Sauerstoff, was bedeutet, dass Schwefel und Sauerstoff chemisch miteinander eng verwandt sind. So gibt es Schwefel auch in Form von S2--Ionen, analog zu den Sauerstoff-Anionen O2-. Und diese S2- -Ionen kommen zum Beispiel im Schwefelwasserstoff, H2S, einem äusserst übelriechenden Gas, oder in organischen Verbindungen, den sogenannten Thiolen, vor. „Thio-“ ist altgriechisch für Schwefel und die Endung „-ol“ weist auf die chemische Verwandschaft hin: Thiole sind die schwefelhaltigen Geschwister der Alkohole.
Ebenso haben auch die Aldehyde und Ketone (Sauerstoffverbindungen, die entstehen, wenn man Alkohole oxidiert – darunter Acetaldehyd, das uns nach Alkoholgenuss den Kater beschert) schwefelhaltige Geschwister.
All diese organischen Schwefelverbindungen sind oft ziemlich üble Stinker, und das nicht von ungefähr: Wie Schwefelwasserstoff sind einige Thiole hochgiftig, sodass der Gestank uns Menschen aus gutem Grund dazu bewegt, vor ihnen wegzulaufen. Andere Verbindungen werden von Pflanzen verwendet, um ihre Fressfeinde abzuschrecken. Ein bekanntes Beispiel dafür sind Zwiebeln. Der Stoff, der uns beim Schneiden von Zwiebeln Tränen in die Augen treibt, um uns vom Zerstören der Knollen abzuhalten, gehört auch zur Grossfamilie der schwefelorganischen Verbindungen.
Wie Schwefel an das Silber kommt
Tatsächlich kann man Thiole und andere schwefelorganische Verbindungen – und damit auch Schwefelwasserstoff in kleinen Mengen – überall dort finden, wo Leben ist oder war. Zum Beispiel in Lebensmitteln, auf unserer Haut oder auch in Kosmetika. So ist es nur natürlich, dass unser Tafelsilber und Silberschmuck, wenn wir sie benutzen, nebst Sauerstoff auch mit S2--Ionen in Berührung kommt.
Und die bilden mit Silberionen, Ag+, ein schwarzes, wasserunlösliches Salz, das Silbersulfid Ag2S:
2Ag+ + S2- –> Ag2S
Dabei wird eine Menge Energie frei. Das bedeutet, dem fertigen Silbersulfid wohnt viel weniger Energie inne als dem Silber-Metall und den S2--Ionen. Und Zustände mit möglichst wenig Energie strebt die bequeme Natur stets an. Der Zustand als Silbersulfid ist sogar dermassen erstrebenswert, dass Luftsauerstoff aus Silber-Metall Silber-Ionen machen kann (das geht normalerweise nicht von selbst), wenn S2- zur Stelle ist, um mit letzteren Silbersulfid zu bilden. Und zwar direkt an der Oberfläche des Silber-Metalls, wo die Ag+-Ionen entstehen. So bleibt das wasserunlösliche Silbersulfid gleich dort und bildet die dunkle Patina, die Silber so häufig überzieht.
Wie wird man die Silbersulfid-Schicht wieder los?
Grundsätzlich gibt es zwei Wege, die schwarze Schicht von der Silberoberfläche zu bekommen:
- Man schrubbt oder löst sie ab – dann ist das Silber darin aber verloren.
- Man macht aus den Silberionen darin wieder metallisches Silber und setzt die Sulfid-Ionen frei.
Ich ziehe den zweiten Weg dem ersten vor, um möglichst viel Silber an meinen Gegenständen zu erhalten. Und dazu gibt es neben kommerziellen Reinigungsmitteln verschiedenste Hausmittel im Netz. Besonders interessant – weil so einfach und wirksam, finde ich dieses:
Silber mit Aluminiumfolie in Salzwasser reinigen
Ihr braucht dazu
- euer angelaufenes Silber (Besteck, Tafelsilber oder Schmuck ohne Steine oder sonstiges Beiwerk!)
- Aluminiumfolie
- etwas Kochsalz
- Leitungswasser
- Kochtopf und Herd
- einen gut belüfteten Raum bzw. eine Dunstabzugshaube zum Herd
- eine Grillzange oder ein ähnliches Greifwerkzeug

So geht’s
- Füllt Wasser in den Topf (es soll eure Silbergegenstände später ganz bedecken) und gebt einen Löffel Kochsalz hinzu (als wolltet ihr z.B. Spaghetti kochen)
- Bringt das Wasser auf dem Herd zum Kochen
- Zerteilt inzwischen die Aluminiumfolie in kleine Schnipsel und gebt sie in das kochende Wasser. Die Schnipsel sollten ganz ins Wasser eingetaucht sein – hierzu ist die Grillzange sehr nützlich!
- Legt den Silbergegenstand in das kochende Wasser, lasst das Ganze kurz aufkochen und nehmt das Silber mit der Zange wieder heraus (Vorsicht, heiss!). Wenn ihr das ganze Tafelsilber säubern wollt, wiederholt diesen Schritt einfach mit den nächsten Teilen.
- Lasst das Metall kurz abkühlen und trocknet es gründlich ab

Was ihr beobachten könnt
Das Silber wird innerhalb einer Minute oder weniger wieder hell und glänzend. Der aufsteigende Wasserdampf riecht währenddessen ein wenig nach faulen Eiern – deshalb grössere Mengen nicht einatmen, gut lüften oder den Abzug verwenden!
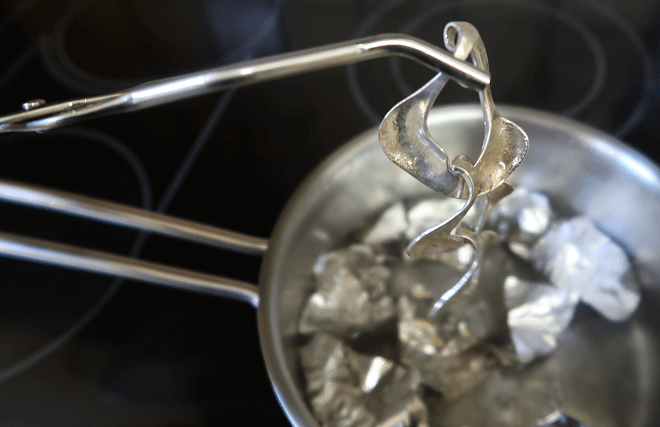
Was passiert da?
Aluminium ist ein sehr unedles Metall. Es wird also leicht oxidiert. Oxidation bedeutet: Das Aluminium gibt Elektronen an einen Reaktionspartner ab:
Ein möglicher Reaktionspartner, der freiwillig Elektronen von Aluminium entgegennimmt (die Aufnahme von Elektronen eines Reaktionspartners heisst Reduktion), sind Silberionen, Ag+:

Rechts: Nach dem Kochen, Abkühlen und Trocknen glänzt das Silber wieder hell.
Euch kommt das irgendwie bekannt vor? Richtig: Aluminiumfolie als Rostfänger in der Spülmaschine funktioniert ganz ähnlich! Mit dem Unterschied, dass das Aluminium dort der Entstehung von Flugrost (d.h. Eisen-Ionen) zuvorkommt, weil es leichter als Eisen oxidiert wird.
Für die Reduktion von Silbersulfid müssen die Elektronen aber irgendwie vom Aluminium in der Folie zum Silbersulfid an der Oberfläche unseres Tafelsilbers gelangen. Und Elektronen, die auf Wanderschaft gehen, sind elektrischer Strom.
Elektronentransport dank Elektrolytlösung
Hier kommt das Kochsalz, NaCl, ins Spiel. Gibt man es ins Wasser, löst es sich nämlich in Na+– und Cl–-Ionen auf. Und Ionen, die sich in einer Flüssigkeit bewegen können, leiten den elektrischen Strom! Anders als in einem Kabel, durch welches Elektronen einfach hindurchströmen, wandern positiv geladene Ionen (Kationen) hierzu durch die Flüssigkeit dorthin, wo es viele Elektronen gibt (zur „Kathode“), um dort Elektronen (hier vom Aluminium) „huckepack“ zu nehmen, während die negativen Ionen (Anionen) dorthin wandern, wo wenig Elektronen sind (zur „Anode“), um dort Elektronen abzugeben (hier an die Silberionen). Eine solche leitfähige Flüssigkeit nennen die Chemiker „Elektrolyt“.
Ebenso wie Kochsalz funktionieren natürlich auch andere wasserlösliche Salze als Bestandteil der Elektrolytlösung zum Silberputzen. Natron, Soda oder Backpulver werden gerne als Alternativen genannt. Diese reagieren allerdings basisch und bilden mit vielen Metallen – auch Aluminium – schwer lösliche Hydroxide. Und die könnten die Oberfläche der Aluminiumfolie für die Redox-Reaktion mit dem Silber blockieren („passivieren“). Deshalb – und weil Basen die Haut eher reizen als neutrale Stoffe oder Säuren – finde ich Kochsalz als Elektrolyt einfach bequemer.
Da auf diese Weise sehr bequemes Silbersulfid zerstört werden soll, braucht es zusätzlich noch Energie, damit das Ganze funktioniert. Und die fügen wir durch das Erhitzen zu.
Und woher kommt der Geruch nach faulen Eiern?
Wenn die Ag+-Ionen zu metallischem Silber reagieren, bleiben die S2--Ionen übrig:
Die bleiben aber ungern nackt und einsam, sodass sie sich sofort von den nächstbesten Wassermolekülen H+-Ionen schnappen:
Also insgesamt:
Das Gas H2S, also Schwefelwasserstoff, ist giftig, wasserlöslich, verdampft aber leicht – ganz besonders, wenn die Lösung gerade kocht. Deshalb können wir es im Wasserdampf, der aus unserem Topf mit dem Silber aufsteigt, riechen. Aber keine Sorge: Gerade weil dieses Gas so giftig ist, ist die menschliche Nase darauf äusserst empfindlich. Bevor wir gesundheitsschädliche Mengen davon einatmen können, sind wir in aller Regel längst vor dem Gestank davongelaufen.
Trotzdem solltet ihr euren Raum, in dem ihr Silber auf diese Weise putzt, gut lüften oder die Dunstabzugshaube einschalten, damit sich das Gas nicht sammelt – und damit nicht eure ganze Wohnung danach stinkt 😉 .
Was passiert, wenn man viel Silber reinigt?
Wenn ihr viel Silber reinigt, könnte es auch mit Kochsalz als Elektrolyt passieren, dass eure Alufolienschnipsel stumpf werden. Denn dank der frei werdenden S2--Ionen kommt ihr letztlich um die Entstehung von Hydroxiden (Verbindungen mit OH–-Ionen) nicht herum. So lassen sich alle Gleichungen oben zu einer einzigen Reaktionsgleichung zusammenfassen:
Sollte sich das Aluminiumhydroxid Al(OH)3 an der Oberfläche der Alufolie sammeln, bis das Reinigen des Silbers nicht mehr funktioniert, tauscht die Folienschnipsel einfach gegen frische Schnipsel aus. Zudem könnt ihr die Haltbarkeit der Folienschnipsel etwas verlängern, indem ihr ein wenig Säure, zum Beispiel Zitronensäure, zur Salzlösung gebt.
Wenn ihr euch gut mit Chemie auskennt, könntet ihr natürlich eine Pufferlösung einzusetzen, um die Alufolie noch deutlich länger „frisch“ zu halten. Aber das ist eine andere Geschichte.
Entsorgung
Da bei diesem Verfahren Silberionen an der Silberoberfläche zu metallischem Silber reduziert werden, sollte eure Salzlösung nach dem Kochen praktisch kein Silber enthalten. Das Aluminium reagiert ebenfalls zu schwer löslichen Salzen (spätestens dann, wenn ihr die gebrauchte Lösung mit etwas Natron basisch macht).
Wenn die, nachdem ihr viel Silber gereinigt habt, als sichtbare Schlieren oder Trübung aus der Lösung ausfallen, könnt ihr die Flüssigkeit filtrieren, das Filterpapier (z.B. einen Kaffeefilter) trocknen lassen und in den Hausmüll geben.
So könnt ihr die verbleibende Salzlösung nach dem Abkühlen – und nachdem ihr die Folienschnipsel herausgenommen habt, in den Ausguss entsorgen.
Die Folienschnipsel könnt ihr wie anderes Haushalts-Aluminium auch in den Recycling-Abfall geben (in der Schweiz in den Container an der Abfall-Sammelstelle, in Deutschland und Österreich über die gelbe Tonne).
Wenn ihr ausserdem Kupfer oder Messing putzen möchtet: Auch dafür gibt es einen einfachen Chemie-Trick – den findet ihr hier!
Und wie putzt ihr euer Silber für gewöhnlich?
Hast du das Experiment nachgemacht:
[poll id=“5″]
Wenn etwas nicht oder nur teilweise funktioniert haben sollte, schreibt es in die Kommentare. Ich helfe gerne bei der Fehlersuche!












