Weichspüler haben einen schlechten Ruf: Ich lese auf Facebook in einigen Haushaltsgruppen mit und schnappe dort auf, was euch Haushaltsbetreibende so bewegt. Dabei lese ich immer wieder Beiträge nach dem Prinzip „Hilfe, meine Waschmaschine stinkt!“ und die dazugehörigen Antworten. Die gehen dann meistens in Richtung „Benutzt du Weichspüler? Mach das bloss nicht, die schaden der Maschine und können der Grund für den miesen Geruch sein!“
Obendrauf kam im Sommer 2019 ein wohl ziemlich unsachlicher Beitrag des SWR, der anprangerte, dass eklige Schlachtabfälle als Rohstoffe für Weichspüler verwendet würden und sie damit alles andere als vegan seien.
Wenn diese Waschhilfsmittel so viele schlechte Eigenschaften in sich vereinen, warum werden sie dann in so vielfältiger Ausführung produziert und gekauft?
In diesem Artikel gehe ich den Weichspüler-Mythen auf den Grund: Schaden Weichspüler wirklich der Waschmaschine (oder gar unserer Gesundheit) oder werden sie fälschlicherweise verteufelt?
Was sind eigentlich Weichspüler?
Weichspüler sind in der Regel flüssige Produkte, die kationische Tenside (auch „Invertseifen“ genannt) enthalten. Diese besonderen Tenside werden in der Waschmaschine beim letzten Spülgang hinzugefügt und sollen dafür sorgen, dass die Wäsche nach dem Trocknen weicher ist.
Zusätzlich wirken viele Weichspüler gegen elektrische Aufladung (einige der kationischen Tenside sind sogenannte Antistatika), enthalten verschiedene Duftstoffe, optische Aufheller und zuweilen geruchsbindende Moleküle.
Warum wird Wäsche beim Trocknen hart?
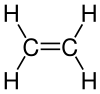
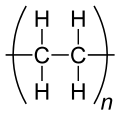
Beim Trocknen von Wäsche kann es zur sogenannten „Trockenstarre“ der Textilien kommen. Dabei bilden sich Wasserstoffbrücken-Bindungen zwischen Fasern aus Zellulose, die diese Fasern vorübergehend „verkleben“. So wird ein ursprünglich flexibler Stoff hart und steif.
Zellulose ist doch der Pflanzenbestandteil, aus dem man Papier macht? Richtig! Aber ebenso ist er der Hauptbestandteil von Baumwollfasern, aus denen man Textilien macht.
Ganz besonders deutlich erlebe ich die Trockenstarre an meinem Oberteil aus Viskose. Dieses Material ist nämlich nichts anderes als Gewebe aus einem Garn, das aus verflüssigter Zellulose neu gesponnen wurde (eine sogenannte Regeneratfaser). Chemisch unterscheiden sich die Moleküle in diesem Garn nicht von natürlicher Baumwolle. Die Neigung zur Trockenstarre eingeschlossen.
Wenn ich besagtes Kleidungsstück wasche und auf der Leine trockne, fühlt es sich nachher steif wie ein Brett an. Allerdings nicht für lange. Spätestens wenn ich es ein paar Minuten getragen habe, fällt es wieder weich und geschmeidig, als wäre nichts gewesen. Das rührt daher, dass Wasserstoffbrücken im Vergleich zu „richtigen“ chemischen Bindungen (d.h. Atombindungen) nicht besonders fest sind. Das macht sie bei ausreichend Bewegung entsprechend kurzlebig.
Was kann ein Weichspüler dabei bewirken?
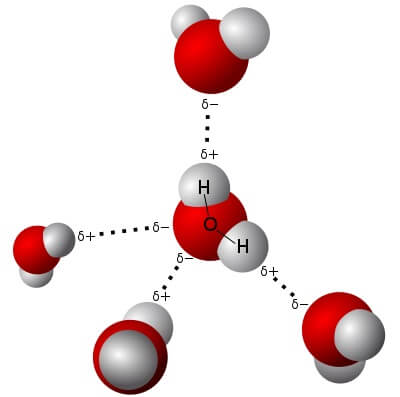
Die kationischen Tenside im Weichspüler heissen so, weil ihre Moleküle eine positive elektrische Ladung tragen. Damit finden sie dicht mit Elektronen umgebene (und damit leicht negativ geladene) Atome äusserst anziehend und lagern sich an solche gerne an. Doch genau diese elektronenreichen Atome sind auch für die Entstehung von Wasserstoffbrücken notwendig. Wenn jedoch ein kationisches Tensid solch ein Atom besetzt, bleibt dort kein Platz mehr für eine Wasserstoffbrücke. Und ohne Wasserstoffbrücken keine Trockenstarre.
Was genau sind kationische Tenside?
Tenside im Allgemeinen sind Moleküle, deren eines Ende gut wasserlöslich ist, während das andere Ende überhaupt nichts von Wasser hält. Die Wasserlöslichkeit eines Moleküls geht mit einer elektrischen Ladung oder ungleicher Elektronenverteilung zwischen den Atomen einher. Die alltäglichsten Tenside sind Seifen. Sie tragen eine negative elektrische Ladung („anionische Tenside“) und sind für ihre Superwaschkraft hoch geschätzt (mehr dazu erfahrt ihr hier).
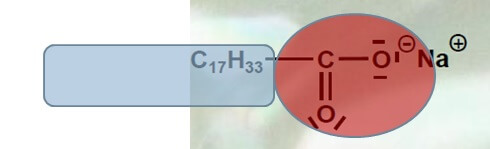
Kationische Tenside tragen dagegen eine positive elektrische Ladung. Sie enthalten in der Regel ein Stickstoffatom, das vier Bindungen statt seiner üblichen drei eingegangen ist. Damit teilt das Stickstoffatom ein Elektron mehr als üblich mit seinen Nachbarn, weshalb seine Kernladung um +1 überwiegt.
Vom Ammonium zum Tensid
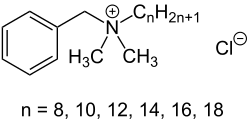
Das einfachste Molekül dieser Art ist das Ammoniumion NH4+, in dem vier Wasserstoffatome an den Stickstoff gebunden sind. Klein und geladen ist dieses Molekül sehr gut wasserlöslich. In einem kationischen Tensid sind die vier Wasserstoffatome jedoch durch Kohlenwasserstoffreste ersetzt. Wenn mindestens einer davon so lang ist, dass seine Unlöslichkeit in Wasser sich bemerkbar macht, ist das Molekül ein Tensid.
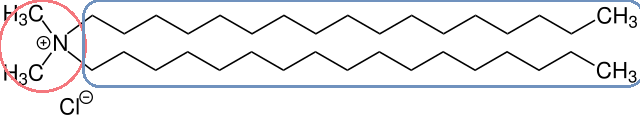
Weil sie sich vom Ammonium ableiten und alle vier H-Atome durch Kohlenwasserstoffreste ersetzt sind, werden Moleküle dieser Sorte „quartäre Amine“ oder kurz „Quats“ genannt.
Quats sind im Alltag weit verbreitet
Vielleicht kennt ihr das ein oder andere schon als Antistatika zum Aufsprühen oder für seine Wirksamkeit gegen Bakterien und Pilze (Benzalkoniumchlorid, ein bekanntes Konservierungsmittel, gehört auch zu dieser Familie!). Oder als „Weichmacher“ der anderen Art: Polyquaternium-Verbindungen sind, als Alternative zu Silikonöl, Bestandteile z.B. von Haarspülungen. Darin sind die positiv geladenen Stickstoffatome zu längeren Ketten verknüpft, die sich um die Haare legen und ihnen eine glatte Oberfläche und damit leichte Kämmbarkeit verleihen.
Wie gut sind Weichspüler biologisch abbaubar?
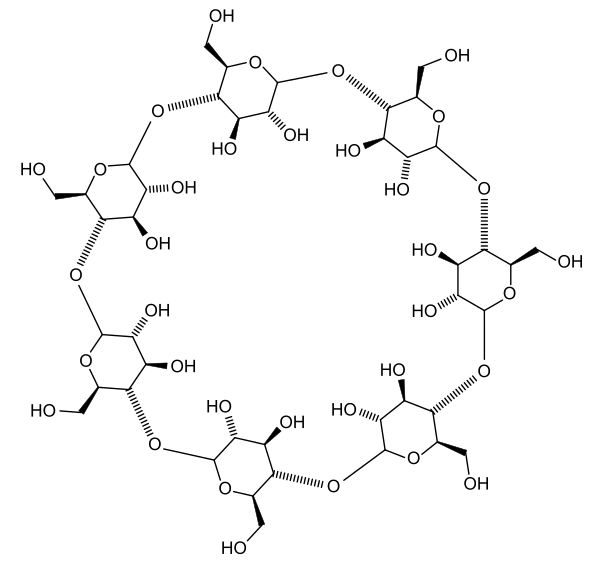
In den 1990ern kamen in Weichspülern meist simple „Quats“ wie das oben gezeigte DSDMAC zum Einsatz. Die haben jedoch einen entscheidenden Nachteil: Es gibt sie in der Nahrung von Lebewesen, insbesondere Kleinstlebewesen, nicht, was bedeutet, dass sie nur schwerlich bis gar nicht biologisch abbaubar sind.
Da eine vernünftige biologische Abbaubarkeit von Tensiden wie in Weichspülern aber seit 2006 von der EU vorgeschrieben ist, kommen heutzutage angepasste Moleküle zum Einsatz. Anstatt einfacher Kohlenwasserstoffreste sind darin Alkohol-Gruppen an den Stickstoff gebunden, die mit Fettsäuren verestert sind. Diese Verbindungen, kurz „Esterquats“ genannt, ähneln damit den Fetten bzw. Triglyceriden, die wir alle als Nahrung kennen. Somit ist die Natur gut für die Spaltung und Verwendung solcher Verbindungen gerüstet. Das heisst, die Esterquats sind gut biologisch abbaubar.
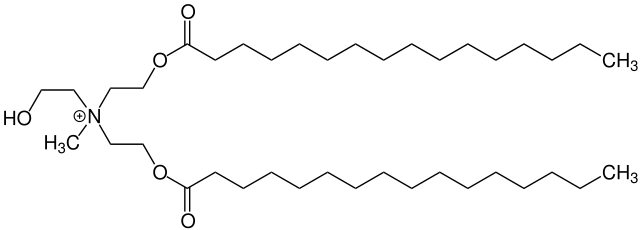
Zumindest in der Theorie ist das eine tolle Sache. Beim Herumstöbern im Netz nach den Inhaltsstoffen von Weichspülern bin ich allerdings auf ein Sicherheitsdatenblatt eines Produkts einer aus der Werbung gut bekannten Firma gestossen – und siehe da: Der wirksame Bestandteil ist kein Esterquat, sondern unter anderem das (un)gute alte DSDMAC. Immerhin habe ich diese Angabe des betreffenden Herstellers gefunden, während sich andere gar nicht in die Karten schauen lassen.
So halte ich die Aussage auf Wikipedia, dass DSDMAC und Co. Heutzutage durch Esterquats ersetzt sind, für höchst fraglich.
Schlachtabfälle?! – Wie man quartäre Amine herstellt
Der anfangs erwähnte Beitrag des SWR wurde nicht zuletzt dafür kritisiert, dass er den Eindruck erweckte, in Weichspülern ’seien eklige Schlachtabfälle drin‘ (was von der Boulevardpresse nur zu gern aufgegriffen wurde).
Tatsächlich sind die Rohstoffe, aus denen man „Quats“ für Weichspüler herstellt, Fette, die von Pflanzen oder Tieren stammen können. Da diese Fette keinen besonderen Qualitätsansprüchen genügen müssen, sind Schlachtabfälle letztlich eine wirtschaftliche und nachhaltige Quelle dafür. Dass die auch rege genutzt wird, ist auch seit langem hinlänglich bekannt.
Die Fette werden jedoch in einer ganzen Reihe von Schritten verarbeitet:
- Die Fette werden zunächst wie bei der Seifenherstellung gespalten („verseift“), um freie Fettsäuren zu gewinnen. Das ebenfalls entstehende Glycerin wird davon abgetrennt.
- Anschliessend lässt man die Fettsäuren bei hoher Temperatur und einem Metallkatalysator (ein Hilfsstoff, der die Reaktion erleichtert) mit Ammoniak (NH3) reagieren, um das Stickstoffatom einzuführen. Es entstehen sogenannte Fettsäurenitrile.
- Nach weiterer Reinigung werden die Fettsäurenitrile mit Wasserstoff (H2) umgesetzt. Auch für diese Hydrierung genannte Reaktion ist ein Metall als Katalysator nötig. Dabei können „Fettamine“ mit einem (wenn dabei Ammoniak anwesend ist), zwei oder drei gebundenen Kohlenwasserstoffresten entstehen.
- In einer Reaktion, die Alkylierung genannt wird, kann ein Fettamin mit drei Kohlenwasserstoffresten (d.h. ein tertiäres Amin) schliesslich mit einem vierten solchen Rest versehen werden.
Nach einem letzten Aufreinigungsschritt ist das quartäre Amin bzw. kationische Tensid dann fertig. Insgesamt braucht es also vier chemische Reaktionen und mindestens fünf Reinigungsschritte, um vom natürlichen Rohstoff zum Inhaltsstoff für Weichspüler zu kommen. Nach so viel Aufwand und chemischen Umbau-Aktionen bleibt vom Charakter des ursprünglichen Rohstoffs, ob nun tierisch oder pflanzlich, im Endprodukt nichts mehr übrig.
Weichspüler und vegan? Eine Frage der Definition!
Weichspüler mögen also nicht vegan sein (wenn man „vegan“ denn streng als „ohne Tierprodukte“ definiert). Aber dafür müssen keine Tiere sterben! (Denn die werden für Steak und Hamburger geschlachtet.) So lange ein erheblicher Teil der Menschheit also Fleisch isst, ist es (nicht nur) in meinen Augen wesentlich nachhaltiger, Chemikalien aus dem zu produzieren, was soundso anfällt, als unnötig Ressourcen und Energie aufzuwenden sowie Pestizid- und ähnliche Belastung zu riskieren, um extra pflanzliche Rohstoffe zu produzieren.
Wenn man „vegan“ mit Hintergedanken an Umwelt, Tierschutz und Nachhaltigkeit als „dafür müssen keine Tiere sterben“ bzw. „verbraucht minimale Ressourcen“ definiert, könnte man selbst die Produkte aus tierischen Rohstoffen guten Gewissens als ‚vegan‘ bezeichnen.
Weitere Nachteile von Weichspülern
- In manchen Textilien können Weichspüler ähnliche Probleme machen wie ihre Verwandten in den Haar-Conditionern: Sie lagern sich auf den Geweben ab (das ist ja ihre Funktion!) und „verkleben“ bzw. „verschliessen“ sie so, dass ihre Durchlässigkeit für andere Stoffe beeinträchtigt wird. Das ist vor allem bei Funktionstextilien („atmungsaktive“ Sportkleidung) oder Daunen ein Problem.
- Tatsächlich können Weichspüler sich auch in ähnlicher Weise auf den Oberflächen in der Waschmaschine ablagern und zu einem behaglichen Zuhause für Bakterien und Pilze werden (von denen dann der unangenehme Geruch der Maschine herrührt).
- Unterschiedliche Ladungen ziehen sich an: So bilden kationische Tenside mit den herkömmlichen anionischen Waschmittel-Tensiden schwer wasserlösliche Aggregate. So ist bei der nächsten Wäsche nach dem Weichspülereinsatz mehr Waschmittel nötig als ohne.
- Duftstoffe (und weitere Zusätze) können Allergien auslösen (müssen aber nicht). Grundsätzlich sind Allergien bzw. die Neigung dazu von Mensch zu Mensch sehr verschieden, sodass kaum vorauszusagen ist, wer auf was empfindlich reagiert.
Was (oder wem) nutzen Weichspüler dann überhaupt?
Mangelnde biologische Abbaubarkeit, unliebsame Rohstoffe, Probleme bei Funktionstextilien, Keime in der Waschmaschine und allergenes Potential… das ist eine lange Liste von Nachteilen, wenn die Wirkung von Weichspülern sich bloss auf das Verhindern der zeitlich begrenzten Trockenstarre, Duft und etwas Antistatik beläuft.
Ich habe allerdings von Menschen gelesen, die womöglich nicht darauf warten können/mögen, dass eine Trockenstarre von selbst verfliegt: Nämlich solche, die an Neurodermitis oder anderen Erkrankungen mit leicht reizbarer Haut leiden. Solchen sollen Hautärzte tatsächlich den Einsatz von Weichspülern empfehlen, wenn damit Reizungen durch „kratzige“ Textilien zuvorgekommen werden kann.
Aus dem eigenen Familienkreis kenne ich Neurodermitis nur mit allergischem Ursprung, wenngleich wohl Nahrungsmittelproteine (Milch, Ei) die Ursache waren. Nichts desto trotz erscheint es mir hier sinnvoll, von Person zu Person abzuwägen, inwieweit der Nutzen eines Weichspülers mögliche Reaktionen auf seine Inhaltsstoffe überwiegt.
Gibt es denn (Hausmittel-)Alternativen zu industriellem Weichspüler?
In den Haushaltsgruppen und auf zahllosen Websites werden immer wieder vor allem Essig, Natron/Soda (oder gleich beide miteinander) und/oder ätherische Öle als Weichspüler-Ersatz empfohlen. Doch was taugen diese Alternativen?
Aus Chemikersicht gar nichts:
- Essig: Enthält Essigsäure – die reagiert mit dem schwach basischen Kalk in (hartem) Waschwasser. Essig trägt also zur Wasserenthärtung bei und kann allenfalls dazu beitragen, den Verbrauch von Waschmittel durch die Entstehung von Kalkseifen oder Kalkablagerungen auf den Textilien zu verhindern. Heute Waschmittel enthalten allerdings bereits Enthärter (vor allem Zeolith A), die das übernehmen. Und zu viel Essigsäure in der Maschine kann um ungünstigsten Fall ihre Bauteile angreifen.
- Natron und Soda (Natriumhydrogencarbonat, NaHCO3 bzw. Natriumcarbonat Na2CO3): Sind basisch und und fluoreszieren in UV-Licht. Letztere Eigenschaft macht sie zu optischen Aufhellern: Sie lassen die Wäsche weisser erscheinen (zumindest theoretisch: Die Stiftung Warentest hat 2013 keinen solchen Effekt nachweisen können) – machen sie aber nicht weicher. Ausserdem sind Basen ähnlich wie Säuren aggressiv: Nicht alle Fasern vertragen sie so ohne weiteres.
- Essig und Natron oder Soda: Reagieren miteinander. Die dabei freigesetzte Kohlensäure zerfällt in CO2-Gas und Wasser. So gehen sowohl die enthärtende Wirkung des Essigs als auch die Fluoreszenz verloren.
- Ätherische Öle: Werden gerne als „natürlicher“ Ersatz für die Duftstoffe in Weichspülern genannt. Dabei geht jedoch gerne vergessen, dass auch und gerade die Bestandteile ätherischer Öle Allergien auslösen können (viele der fraglichen Duftstoffe in industriellen Produkten kommen sogar auch in ätherischen Ölen vor oder leiten sich davon ab!). Dazu kommt: Die Zusammensetzung von Naturprodukten wie ätherischen Ölen ist weder vollständig bekannt noch garantiert immer gleich – anders als bei „chemischen“ Zubereitungen, die stets bis ins Detail bekannt sind. Daher solltet ihr beim Einsatz fortwährend genau und von Person zu Person beobachten, wer was verträgt und was nicht.
Wie ich als Chemikerin vorgehe
Da in meinem Haushalt niemand unter Neurodermitis oder ähnlichem leidet, ist mir die Liste der Nachteile von Weichspülern gegenüber ihrem Nutzen viel zu lang.
Ich wasche daher meine Wäsche nur mit einem Vollwaschmittel in Pulverform und verzichte auf Weichspüler. Frottee-Handtücher (die ich nur trocknergeeignet kaufe) trockne ich im Wäschetrockner, denn durch dessen Gebläse wird die Trockenstarre von vorneherein verhindert. Von meiner Bluse aus Viskose (und anderer betroffener Kleidung) weiss ich überdies inzwischen, dass die Trockenstarre von selbst so vollständig vergeht, dass ich die Bluse nicht einmal bügeln muss.
Und wie wascht ihr eure Wäsche? Verwendet ihr Weichspüler? Habt ihr einen besonderen Nutzen davon? Oder warum verwendet ihr sie gerade nicht?