Wie funktioniert unser Immunsystem? Was passiert damit beim Impfen? Sind Impfstoffe gefährlich?
Das Titelbild zeigt mein Impfbuch – ein treuer Begleiter seit über 35 Jahren, wie der Zustand unschwer erkennen lässt. Da lässt sich erahnen, dass mir die Wertschätzung für das Impfen förmlich in die Wiege gelegt worden ist. Tatsächlich vermittelten meine Eltern mir den Gang zum „Onkel Doktor“ für den kleinen Pieks als eine Selbstverständlichkeit – das gehörte zum Leben dazu wie der Besuch beim Coiffeur. Als ich schliesslich zur Schule ging, konnte ich den Sinn des Ganzen auch selbst auf den Plakaten in der Kinderarztpraxis lesen: „Schluckimpfung ist süss, Kinderlähmung ist grausam!“
Und je mehr ich im Laufe meines Lebens über diese und andere Infektionskrankheiten erfuhr, desto dankbarer war und bin ich meinen Eltern dafür, dass sie dereinst so bereitwillig für meine Grundimmunisierung gesorgt haben. Denn damit bin nicht nur ich vor Masern, Röteln und Co geschützt, sondern muss mich auch nicht darum sorgen, solche Krankheiten auf meine kleinen Nichten oder andere (noch) nicht Geimpfte zu übertragen.
So habe ich bis meiner Impfschutz-Sammlung auch aus eigenem Antrieb Ergänzungen beigefügt, wie zum Beispiel gegen die Zecken-Enzephalitis („FSME“), nachdem ich heute in einem Verbreitungsgebiet lebe und hobbybedingt gerne durch die Botanik streife.
Aber was bewirkt so ein Impfstoff eigentlich, und wie kann er uns vor Infektionen schützen? Das verstehen Wissenschaftler heute sehr gut, da sie (nicht nur) das menschliche Immunsystem gut verstehen. Und damit auch ihr Impfstoffe verstehen könnt, möchte ich hier zunächst das Immunsystem vorstellen – anhand eines grossen Lehrbuchs für Zellbiologie [1], in welchem die Wissenschaftler ihr Wissen für uns aufgeschrieben haben:
Wie funktioniert die Immunabwehr?
Das Immunsystem unseres Körpers muss eine Vielfalt unterschiedlichster Erreger und Bedrohungen abwehren. Wie jedes wirksame Sicherheitssystem besteht es deshalb aus mehreren Verteidigungslinien, die sich gegenseitig ergänzen:
1. Angeborenes (natives) Immunsystem
Mauern und Barrieren: Der Körper als Festung
Die erste dieser Verteidigungslinien besteht aus mechanischen Barrieren, die dem Körper selbst gegeben sind: Der ganze Organismus ist von der schwer durchdringbaren Haut umgeben, die Aussen- und Innenleben strikt getrennt hält. Nähr- und Abfallstoffe werden hauptsächlich in begrenzten Bereichen (vornehmlich in Hohlräumen innerhalb des Körpers wie Mund, Atemwegen und Verdauungsorganen) ausgetauscht. In diesen Bereichen ist die Haut um dieses Austausches willen dünner und durchlässiger, aber mit Schleim (man spricht deshalb von Schleimhaut), keimtötenden Stoffen und stets nach ‚draussen‘ gerichteten Transportsystemen besonders gesichert. Zudem ist sie mit nützlichen, dort sehr willkommenen Bakterien „bemannt“.
Die meisten unerwünschten Kleinstlebewesen aus unserer Umgebung – Bakterien, Pilze oder Parasiten – bleiben so auf die Hautoberfläche beschränkt oder werden mit Schleim oder anderen Ausscheidungen gleich wieder vor die Tür gesetzt. Oder sie gehen ein, ehe sie merken, dass sie es in eine der Körperhöhlungen geschafft haben.
Einige Erreger sind jedoch findiger: Sie klammern sich an Schleimhäuten oder Flimmerhärchen fest, finden einen Weg durch Hautverletzungen oder lassen sich als blinde Passagiere von stechenden oder beissenden Tieren (vornehmlich Insekten) direkt durch die Haut befördern. Einmal im Körperinnern angekommen verstecken sie sich in körpereigenen Zellen, indem sie – wie manche Bakterien – sich absichtlich von ihnen „fressen“ lassen, sich durch die Zellwand oder andere Barrieren bohren – wie Parasiten – oder, wenn es sich um Viren handelt, ihr Erbgut in die Zelle schmuggeln.
Alarmanlage: Das Komplementsystem
Mikroorganismen sind glücklicherweise grundlegend anders gebaut als Menschenzellen: So gibt es Proteine, die „fremde“ Muster und Bauweisen erkennen können und Alarm schlagen, wenn ihnen Befremdliches begegnet. Dieser Alarm äussert sich in einer typischen Entzündungsreaktion (Rötung, Schwellung, Schmerzen/unangenehmes Empfinden,..). Im Zuge dieses Alarms werden Giftstoffe freigesetzt, welche die Zellhüllen der Eindringlinge angreifen, aber auch die menschlichen Zellen in der direkten Umgebung nicht kalt lassen (daher und von vermehrter Auslastung der körpereigenen Verkehrswege durch anrückende Verstärkung rührt die Entzündung). Ausserdem ruft der Alarm weitere Teile des Immunsystems auf den Plan.
Die Gesamtheit der an dieser Alarmanlage beteiligten Stoffe wird „Komplementsystem“ genannt. Teile eines solchen Komplementsystems findet man auch in Pflanzen. Somit können auch Pflanzen beim Eindringen von Erregern im betroffenen Bereich in Verteidigungsbereitschaft gehen. Allerdings fehlen ihnen die weiteren Verteidigungslinien, die sich erst in den evolutionsgeschichtlich jüngeren Tieren und Menschen entwickelt haben.
Schnelle Eingreiftruppe: Zellen für die unspezifische Abwehr
Die Zellen des Immunsystems werden als weisse Blutzellen oder „Leukozyten“ (dasselbe auf griechisch) zusammengefasst. Eine Beschreibung dieser Zellen nach Zellsorten findet ihr in dieser Geschichte über die spannendste Chemikalie der Welt: Das Blut.
Der Alarm des Komplementsystems reisst nun zunächst die weissen Zellen in der unmittelbaren Umgebung aus ihrem inaktiven Dasein. Im Gewebe werden so die ‚Makrophagen‘ (griechisch für grosse Fresszellen), in den umliegenden Blutgefässen die ’neutrophilen Granulozyten‘, kleinere Fresszellen, geweckt und machen Jagd auf die Erreger.
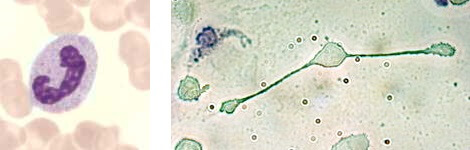
Die Fresszellen erkennen die Eindringlinge an ihrem „fremden“ Muster, fressen sie auf und verdauen sie anschliessend. Dabei sterben die kleineren ‚Neutrophilen‘ meist ab, während die Makrophagen mehrere Mahlzeiten verkraften können. Die Zell-Leichenberge, die von einem Grosseinsatz von ‚Neutrophilen‘ übrig bleiben, erscheinen unserem blossen Auge dann als Eiter.
Spezialmassnahmen gegen besondere Querulanten
Manche Erreger lassen sich so aber nicht klein kriegen: Sie benutzen eine schleimige Zuckerhülle als Tarnkappe, um dem Komplementsystem zu entgehen, setzen die Entzündungs-Alarmanlage ausser Kraft, erweisen sich als unverdaulich, schalten die Verdauungssäfte der Fresszellen aus oder flüchten sogar aus deren „Magen“ und verstecken sich in ihrem Zellinnenraum.
Viren werden vom angeborenen Alarmsystem meist ohnehin nicht erkannt und können in aller Ruhe ihr Erbgut in Wirtszellen einschleusen. Dafür erkennen die Bestandteile so infizierter Zellen das fremde Erbgut häufig und legen ihre ganze Protein-Herstellung lahm, um die Virus-Vermehrung zu verhindern. Ausserdem holen sie dabei die „Flaggen“ (sogenannte I-MHC-Proteine an ihrer Oberfläche) ein, welche eine Wirtszelle als „dem Körper eigen“ kennzeichnen. So können die Spezialagenten unter den Immunzellen, sogenannte ’natürliche Killerzellen‘, die infizierten Zellen an der fehlenden Beflaggung erkennen und mitsamt dem Viren-Erbgut zum Absterben bringen.
Die angeborene Immunabwehr ist damit nicht auf bestimmte Eindringlinge ausgelegt. Sie reagiert auf alles Fremde, und das sehr schnell. Schliesslich soll sie kleinere Angriffe schon im Keim ersticken. Allerdings können manche Angreifer auch diese Verteidigungslinie durchdringen. Besonders bei grösseren Angriffen auf einen komplexen Wirbeltier- bzw. menschlichen Organismus ist die unspezifische Abwehr schnell überfordert.
Deshalb haben Menschen und andere Wirbeltiere eine dritte Verteidigungslinie entwickelt – und auf die kommt es beim Impfen letztlich an.
2. Erworbenes (adaptives) Immunsystem
Das Sondereinsatzkommando: T-Lymphozyten
Das Alarmsystem des angeborenen Immunsystems aktiviert auch das adaptive, das heisst, das anpassungsfähige oder „lernende“ Immunsystem. So können Fress- und andere Zellen Bruchstücke ihrer Mahlzeit auf ihrer Oberfläche zur Schau stellen. Diese „Antigen-präsentierenden Zellen“ werden damit regelrecht zu wandelnden Litfasssäulen, an welchen andere Zellen die Art der Bedrohung ablesen können. Die Meldereiter unter den Antigen-präsentierenden Zellen sind die sogenannten ‚dendritischen‘ (also verästelten) Zellen, die vom Schlachtfeld um die einfallenden Keime in den nächsten Lymphknoten wandern, um den dort ansässigen T-Lymphozyten ihre Beute zu zeigen.
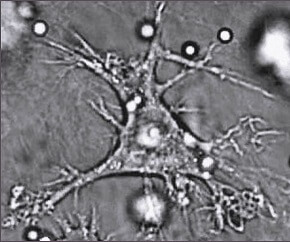
Die T-Lymphozyten sind eine Sammlung von Spezialisten, einer (oder wenige) für jedes nur erdenkliche Antigen. Wenn eine dieser Zellen ihr persönliches Feindbild auf der Anzeige eines dendritischen Meldereiters erkennt, fängt sie an, sich zu vermehren. Je nach Art des Spezialisten entstehen dabei in den Lymphknoten T-Killerzellen, die sich auf den Weg zum Schlachtfeld zu machen, um „ihre“ Feinde auszuschalten bzw. T-Helferzellen, die die verschiedenen Beteiligten an der Abwehr-Schlacht koordinieren.
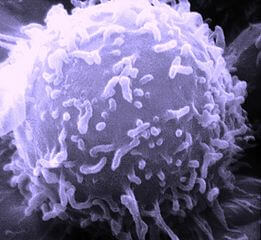
Spezialagenten mit Langzeitgedächtnis: B-Lymphozyten
Ausserdem wird der Alarm an weitere Spezialisten im Knochenmark weitergereicht: Aus B-Lymphozyten gehen dort B-Effektorzellen (auch als Plasmazellen bekannt) hervor, welche vom Knochenmark aus massenhaft (bis zu 2000 pro Zelle und Sekunde!) Antikörper gegen „ihr“ Antigen in die Welt setzen. Diese Antikörper sind Proteine, die exakt auf den jeweiligen Angreifer zugeschnitten sind und mit dem Blut durch den Körper geschwemmt werden, bis sie am Schlachtfeld ankommen. Dort heften sie sich an „ihre“ Antigene, markieren diese für die Fresszellen deutlich erkennbar als Feinde und verkleben die Erreger überdies noch miteinander, sodass die Fresszellen den ganzen Haufen schliesslich nur noch aufräumen müssen
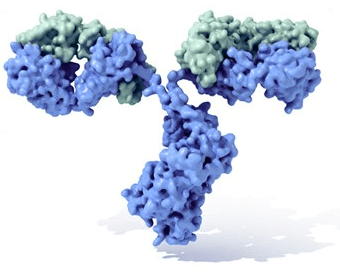
Zudem bringen die ursprünglichen B- und T-Lymphozyten die B- und T-Gedächtniszellen hervor. Diese hochtrainierten Spezialisten für ‚ihr‘ Antigen sind äusserst langlebig: Sie können viele Jahre oder sogar ein ganzes Menschenleben überdauern! Bei neuerlichem Kontakt mit ‚ihrem‘ ganz eigenen Feind können sie zudem sehr schnell viele neue Effektorzellen hervorbringen, die diesem Angreifer im Handumdrehen den Garaus machen – noch ehe der Besitzer des infizierten Körpers wirklich bemerkt, was vor sich geht! Hinzu kommt, dass auch einige der Plasmazellen ein langes Leben haben und während diesem laufend Antikörper ausschütten können. Diese sind dann jederzeit und allerorts zur Hand, wenn ein bekannter Erreger erneut auftaucht, und verhelfen den Fresszellen der angeborenen Verteidigung zu einem schnellen wie effektiven Gegenschlag.
So wird bei einem Angriff auf den Körper stets nur der Teil des adaptiven Immunsystems aktiviert (beim Erstkontakt dauert es in der Regel ein paar Tage, bis dessen volle Leistung erreicht ist), der auf die vorliegende Bedrohung spezialisiert ist. So werden die Ressourcen des Organismus optimal genutzt. Ausserdem „lernt“ das adaptive Immunsystem mit der Zeit, worauf es schnell und heftig zu reagieren hat. Denn die Antwort der Gedächtniszellen auf eine Bedrohung geht – ganz abgesehen von dem Vorsprung durch bereits vorhandene Antikörper – wesentlich schneller vonstatten als die ‚jungfräulicher‘ Lymphozyten bei einem Erstkontakt.
Wie fehlerfrei ist das Ganze?
Ein dermassen effektives Abwehrsystem darf natürlich keine Fehler machen. Das heisst, es darf nur auf Angreifer reagieren, und nicht etwa auf die Vielzahl körpereigener Stoffe oder harmloser Mitbewohner, die wir alle in uns tragen. Deshalb durchlaufen Lymphozyten an ihrem Entstehungsort (B-Zellen entstehen im Knochenmark („bone marrow“), T-Zellen in der Thymusdrüse) eine strenge Qualitätskontrolle und werden angepasst oder sofort verschrottet, wenn sie in der „Testphase“ auf irgendwelche körpereigenen Stoffe, sogenannte „Selbst-„Antigene, reagieren. Das trifft übrigens die allermeisten heranwachsenden Lymphozyten, sodass nur die Besten der Besten unter ihnen im Immunsystem zum Einsatz kommen.
Als zweite Sicherung ist das adaptive Immunsystem redundant gestaltet: Für die ordnungsgemässe Aktivierung von Lymphozyten braucht es zusätzlich zum abgelesenen Antigen ein allgemeines Signal aus dem angeborenen Infektions-Alarmsystem. Wer wegen irgendetwas unruhig wird, ohne dass Infektionsalarm gegeben ist, wird so bei seiner Aktivierung sofort ausser Gefecht gesetzt und postwendend entsorgt.
Doch manchmal macht das adaptive Immunsystem trotz allem Fehler.
Wenn es dabei ein eigentlich harmloses Molekül als Angreifer erachtet, äussert sich so ein Fehler als Allergie: Allergene bleiben dabei ebenso im „Gedächtnis“ wie andere Antigene, sodass das Immunsystem bei jedem neuen Kontakt damit einen neuen Gegenschlag (allergische Reaktion) ausführt.
Wenn trotz aller Vorsicht Lymphozyten oder andere weisse Zellen auftreten, die Bestandteile des eigenen Körpers als feindlich ansehen, ist die Folge eine sogenannte Autoimmunerkrankung – denn was immer die fehlgeleiteten Zellen angreifen, kann seine Funktion nicht mehr erfüllen, was den Betrieb im Körper stört und schlimmstenfalls unmöglich macht.
Zu den Autoimmunkrankheiten zählt zum Beispiel der Diabetes mellitus Typ 1, im Zuge dessen fehlgeleitete Immunzellen die Inselzellen in der Bauchspeicheldrüse angreifen und zerstören, sodass diese das lebensnotwendige Hormon Insulin nicht mehr herstellen können. So muss ein Typ-1-Diabetiker dieses Hormon einnehmen (in der Regel spritzen oder mit einer Pumpe zuführen), damit sein Zuckerstoffwechsel ordnungsgemäss funktionieren kann.
Wie macht man sich das adaptive Immunsystem beim Impfen zu Nutze?
Viele Erreger, die durchtrieben genug sind, um die angeborene Abwehr zu durchdringen, mischen die Körperfunktionen so gehörig auf, dass wir uns krank fühlen. Das rührt zum Einen von der Entzündungsreaktion im Zuge der Schlacht mit dem angeborenen Immunsystem her. Wir spüren diese Schlacht in Form von Schwellungen, Rötung, Schmerzen, ggfs. Eiterbildung, und manchmal Fieber (die erhöhte Temperatur soll es den Angreifern im Körper ungemütlich machen und die Verteidiger auf Trab bringen). Zum Anderen verursachen Manipulationen durch die Erreger selbst oder von ihnen freigesetzte Giftstoffe uns Unannehmlichkeiten, wie z.B. Durchfall, Husten oder eine laufende Nase – alles, was die sich vermehrenden Keime auf möglichst viele neue Wirte verteilen kann, oder den Erregern anderweitig bei der Besiedelung des Körpers hilft.
Das alles funktioniert, weil die Antwort des adaptiven Immunsystems auf einen Erstkontakt einschliesslich der Botengänge zu den Lymphorganen, Signalübermittlung und Verarbeitung sowie Wanderung bzw. Zirkulation zum Schlachtfeld Zeit braucht. In dieser Zeit können die Erreger, welche die Hürde der angeborenen Abwehr nehmen, sich in (fast) aller Ruhe vermehren und Gift ausschütten.
Wenn ein Erreger jedoch bekannt ist, sorgen die entsprechenden Gedächtniszellen für die Bereitstellung einer besonders schnellen Eingreiftruppe, während der Antikörpervorrat im Blut den angeborenen Verteidigungskräften zu einem entscheidenden Vorteil verhilft. So können bekannte Erreger oft eliminiert werden, bevor sie Gelegenheit haben, ihren Wirt sonderlich krank zu machen – der Wirt erfährt „Immunität“.
Da liegt es nahe, dem adaptiven Immunsystem mit einer Erstinfektion auf die Sprünge zu helfen, die weniger oder gar nicht krank macht. Und dazu hat man mehrere Möglichkeiten entwickelt:
- Man züchtet einen Erregerstamm, der seine krankmachenden Eigenschaften verloren hat. Das kann z.B. ein Bakterienstamm sein, der kein Gift produziert, oder ein Virenstamm, dessen Zell-Invasions-Werkzeug nicht funktioniert. Solch einen Impfstoff nennt man Lebendimpfstoff ( auch wenn der Begriff bei Viren, die ja nicht wirklich leben, nicht so ganz passt). Laut Impfpass waren meine Impfdosen gegen Masern, Mumps, Röteln und Kinderlähmung in den 1980ern und 1990ern von dieser Sorte und „halten“ ein Leben lang.
- Man erzeugt Bruchstücke von Erregern, die als solche erkannt werden, aber nicht funktionstüchtig sind, z.B Fetzen von Bakterien-Aussenhaut mit feindlichem Muster oder ebensolche Virenhüllenteile ohne Inhalt. Solche Bruchstücke nennt man Totimpfstoffe – sie haben gegenüber Lebendimpfstoffen den Vorteil, dass sie nicht durch spontane Mutationen zu wieder funktionsfähigen Erregern für böse Überraschungen sorgen können. Dafür müssen Impfungen mit Totimpfstoffen regelmässig (alle 1 bis 2 Jahrzehnte) wiederholt werden, um den Impfschutz aufrecht zu erhalten. Heutzutage wird gegen Kinderlähmung – wie gegen vieles andere auch – mit einem Totimpfstoff geimpft.
- Wenn der Wirt bereits (möglicherweise) mit einem Erreger in Kontakt gekommen ist, gibt es eine Express-Lösung: Man spielt die Rolle der langlebigen Plasmazellen und verabreicht fertige Antikörper gegen den jeweiligen Erreger. Solch ein Passiv-Impfstoff kann eine bereits begonnene Infektion im Keim ersticken, bietet aber – im Gegensatz zu den beiden aktiven Impf-Methoden – keinen Langzeitschutz. Bekannt sind Passiv-Impfungen gegen Tetanus oder Tollwut, die unmittelbar nach einer infektionsgefährdeten Verletzung verabreicht werden.
Verabreicht man einem Menschen einen Aktiv-Impfstoff, z.B. in den Schulter- oder Oberschenkelmuskel gespritzt, löst dieser eine Antwort des adaptiven Immunsystems einschliesslich der Prägung von Gedächtnis- und ggfs. dauerhaft antikörperliefernden Plasmazellen aus – im Idealfall ohne die Auswirkungen einer grösseren Schlacht mit sich ausbreitenden Krankmachern. Wenn später der wahre Erreger auftaucht, schlägt ihm direkt die scharfe Antwort des trainierten Immunsystems entgegen und gibt ihm keine Gelegenheit, grosses Unheil anzurichten.
Der Passiv-Impfstoff kommt hingegen einer Immunantwort auf einen Erstkontakt zuvor: Anstatt dass nach der Infektion auf die Bereitstellung von Plasmazellen gewartet werden muss, sind die gespritzten Antikörper sofort verfügbar und unterstützen das schnellere angeborene Immunsystem sowie die anlaufende adaptive Abwehr bei der Eindämmung der Infektion, bevor die Erreger sich ausbreiten können.
Wie sicher sind solche Impfstoffe?
Die Statistiken von Gesundheitsbehörden zeigen eindrücklich, dass Impfungen funktionieren: Nach der Einführung von Impfprogrammen sind die Fälle der entsprechenden Infektionskrankheiten dramatisch zurückgegangen.
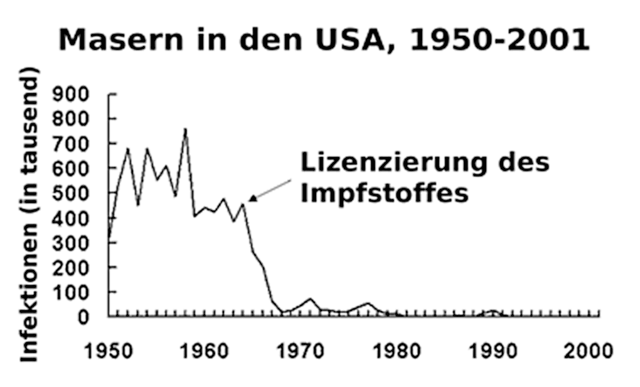
Dabei sind und enthalten Impfstoffe natürlich Fremdstoffe aus Sicht des menschlichen Körpers – wie andere Medikamente, Kosmetikartikel, Nahrungs(ergänzungs)mittel und -zubereitungen und viele andere Gebrauchsgüter, mit denen unser Körper in Kontakt kommt, auch!
Über die nahe Verwandschaft zwischen solchen Fremdstoffen natürlichen und synthetischen Ursprungs habe ich hier ausführlich geschrieben, während der Chemische Reporter sich mit Thiomersal, einer zu Unrecht besonders verrufenen Beigabe zu Impfstoffen, beschäftigt hat.
Und wie bei allen anderen Natur- und Kunstprodukten kann sich das Immunsystem auch bei einem Impfstoff-Bestandteil irren und eine allergische Reaktion vom Stapel lassen. Das kommt aber sehr, sehr selten vor. Und für den seltenen Notfall gilt: Wer impft, muss alles zur Hand und das nötige Wissen haben, um einen lebensgefährlichen allergischen Schock behandeln zu können.
Um solche und andere böse Überraschungen wie spontan zurückmutierende Lebendimpfstoffe zu vermeiden, werden auch im Gebrauch befindliche Impfstoffe laufend überprüft (durch Rückmeldungen impfender Ärzte an damit beschäftigte Institute), weiter entwickelt und sicherer gemacht.
Darüber hinaus ist jeder menschliche Körper und damit jedes Immunsystem einzigartig, sodass auch jeder einzigartig auf die vorgegaukelte Infektion reagiert. Deswegen empfehlen Ärzte, kurz nach einer Impfung grosse körperliche Belastungen zu meiden. Trotzdem bekomme ich beispielsweise von der Wirkung der meisten Impfstoffe gar nichts mit – einzig Hepatitis-Impfdosen zogen eine leichte Schwellung und Druckempfindlichkeit der Einstichstelle nach sich. Solche leichten Infektionsanzeichen, in manchen Fällen auch mit leichtem Fieber und Krankheitsgefühl, sind normal – und allemal besser als eine ausgewachsene Infektion mit all ihren Spätfolgen.
Und die anderen Nebenwirkungen?
Immer wieder werden Impfstoffen und ihrer Verwendung die abenteuerlichsten Nebenwirkungen zugeschrieben – von der Förderung der Entstehung von Autoimmunerkrankungen wie Diabetes Typ 1 über Krebs bis hin zu wirklich abwegig erscheinenden Zusammenhängen zu Krankheitsbildern wie Autismus.
Aber warum sollte eine vorgetäuschte Infektion mit „zahnlosen“ oder toten Erregern bzw. ihren Bruchstücken mehr bewirken als die eigentliche Infektionskrankheit? Es überrascht nicht, dass zahlreiche Studien in Folge solch abenteuerlicher Hypothesen diese Annahmen nicht bestätigen konnten. Im Deutschen Ärzteblatt gibt es eine verständliche Zusammenfassung dieser Ergebnisse.
Dem gegenüber stehen zahlreiche fatale, teils tödliche „Nebenwirkungen“, die mit den eigentlichen Infektionskrankheiten und auch ihrer Behandlung einher gehen.
So gibt es Viren, die Krebs auslösen können – wie zum Beispiel Hepatits-B-Viren (HBV) und einige Stämme des HPV (human papilloma virus), einem Auslöser für Gebährmutterhalskrebs. Mit einer Impfung gegen solche Viren kann Krebserkrankungen sogar vorgebeugt werden!
Gefährliche Hirnentzündungen z.B. in Folge von Masern, lebenslange Verkrüppelung nach Polio („Kinderlähmung“) und die Schädigung ungeborener Kinder im Mutterleib durch Röteln sind nur einige weitere Beispiele für die wirklich dramatischen Folgen von Infektionen, die mit einem gezielten Training des Immunsystems durch Impfstoffe verhindert werden können.
Überdies ziehen viele „wirkliche“ Infektionskrankheiten Behandlungen, auch mit Medikamenten, nach sich – einige davon lebenslang. Gegen bakterielle Infektionen werden Antibiotika eingesetzt, gegen Viren antivirale Medikamente und mehr. Und all diese Medikamente und Therapien haben ganz eigene Nebenwirkungen und Zusatzstoffe, die ihrerseits – nicht immer unberechtigt – Kritik hervorrufen. Ist allein dahingehend „der kleine Pieks“ mit einer kleinen, weitgehend sicheren Dosis nicht das kleinere Übel?
Fazit
Das menschliche Immunsystem besteht aus mehreren Verteidigungslinien aus verschiedenen Zellen und Molekülen, die die meisten ungebetenen Gäste, wie Bakterien, Viren und Parasiten, in gemeinschaftlichem Kampf abwehren. Einige dieser Keime haben jedoch gelernt, diese Verteidigung zu durchbrechen, die Körperfunktionen zu stören und schwere, teils lebenslang spürbare Schäden zu verursachen.
Bemerkenswert sind deshalb die äusserst langlebigen Zellen des adaptiven Immunsystems, die auf bestimmte Erreger spezialisiert sind und Informationen über ‚ihre‘ Feinde jahrzehnte- oder gar lebenslang speichern können, um gefährliche Angreifer künftig schneller und hochwirksam auszuschalten.
Mit Impfstoffen ist es möglich, gezielt solche Informationen in den Gedächtnis-Zellen zu hinterlegen, ohne dass der Körper dazu die jeweilige Krankheit durchmachen muss. So können nicht nur Menschen vor den Folgen schwerer Infektionen geschützt, sondern auch ganze Erregerstämme, die keinen anfälligen Wirt zur Vermehrung finden, ausgerottet werden. Und das Ganze ist mit sehr wenigen Medikamentengaben bei einem verschwindend geringen Risiko folgenschwerer Nebenwirkungen möglich!
Diese spannende und überaus nützliche Errungenschaft der modernen Medizin lässt sich damit frei nach Neil Armstrong beschreiben: „Das ist ein kleiner Pieks für den Menschen, ein riesiger Sprung für die Menschheit.“
Als Schmankerl zum Abschluss habe ich hier die Darstellung des Immunsystems in der Zeichentrickserie „Es war einmal…das Leben“ aus dem Jahre 1986 aufgestöbert:
Wer erkennt die im Artikel beschriebenen Zelltypen und Moleküle wieder? Aber Achtung: Die Darstellung in der Serie enthält Fehler (möglicherweise aus dramaturgischen Gründen)! Wer findet sie?
Und lasst ihr euch auch impfen? Wie gut ist euer Impfbuch gefüllt? Oder weshalb könnt bzw. wollt ihr euch nicht impfen lassen?
[1] B.Alberts, A.Johnson, J.Lewis, M.Raff, K.Roberts, P.Walter: Molekularbiologie der Zelle. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2004


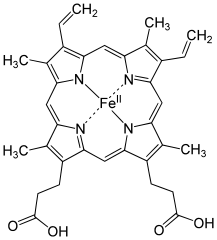 Das in der Abbildung gezeigte Häm b ist dunkelrot. Innerhalb des Kohlenstoff-Rings wechseln sich Einzel- und Doppelbindungen ab. Das bedeutet, dass ein Teil der an den Bindungen beteiligten Elektronen sich relativ frei bewegen und dazu einfallende Lichtquanten „schlucken“ können, sodass das menschliche Auge das verbleibende Licht als farbig wahrnimmt. (
Das in der Abbildung gezeigte Häm b ist dunkelrot. Innerhalb des Kohlenstoff-Rings wechseln sich Einzel- und Doppelbindungen ab. Das bedeutet, dass ein Teil der an den Bindungen beteiligten Elektronen sich relativ frei bewegen und dazu einfallende Lichtquanten „schlucken“ können, sodass das menschliche Auge das verbleibende Licht als farbig wahrnimmt. (







