Es ist Frühling – eine wunderbare Zeit für Experimente, für die man etwas Platz braucht. Deshalb habe ich heute für euch ein lustiges wie lehrreiches Spektakel für Balkon und Terrasse (oder auch für drinnen): Die Elefantenzahnpasta!
Das bekannte Experiment zeigt eine weitere wichtige Fähigkeit (die Gärung könnt ihr ja hier erforschen), die nicht nur Hefezellen, sondern auch unsere Zellen haben: Die Fähigkeit, sich vor Oxidationsmitteln zu schützen. Und da dabei eine Menge Gas entsteht, kann man diese Fähigkeit für dieses spassige Experiment nutzen.
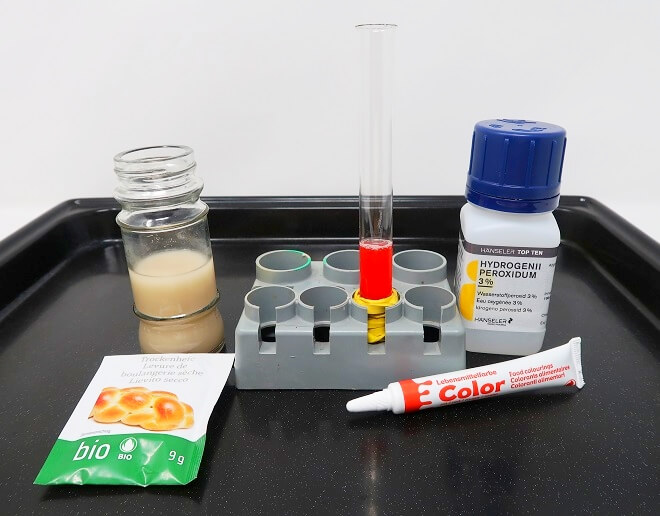
Ihr braucht dazu
- Hefe: am einfachsten geht das Experiment mit Trockenhefe
- ein Gefäss mit schmaler Öffnung: z.B. eine 0,5l PET-Flasche oder ein Reagenzglas
- etwas warmes Wasser (lauwarm, wie Hefe es gern hat)
- etwas Geschirrspülmittel
- ein Oxidationsmittel: Wasserstoffperoxid, als Lösung (3 – 6%) aus der Apotheke/Drogerie
- Optional: Lebensmittelfarbe
- Einen Trichter, der auf das schmale Gefäss passt
- Schutzbrille, ggfs. Labormantel/Malschürze
- Ein Backblech oder Tablett als Unterlage

So geht’s
- Rührt die Trockenhefe in das warme Wasser ein, bis es keine Klumpen mehr gibt.
- Füllt Wasserstoffperoxid in das schmale Gefäss (bis es zu ca. einem Fünftel (mit 6% H2O2) bzw. zwei Fünftel (mit 3% H2O2) gefüllt ist – verwendet dazu den Trichter!) und mischt Lebensmittelfarbe und einen Schuss Spülmittel hinein.
- Stellt das Gefäss in das Backblech.
- Giesst das Hefewasser schnell in das Gefäss und tretet zurück! Die Reaktion beginnt sofort!
Was ihr beobachten könnt
Die Mischung beginnt sofort zu sprudeln und heftig zu schäumen. Wie ein Zahnpastastrang quillt der Schaum aus der Gefässöffnung und ergiesst/schlängelt sich auf dem Backblech aussen herum.

Sicherheitshinweise
Auch wenn sie gerne so genannt wird: Die „Elefantenzahnpasta“ eignet sich nicht zum Zähneputzen! Nehmt sie also nicht in den Mund!
Wasserstoffperoxid wirkt ätzend auf Haut und Schleimhäute (die typischen weissen Verletzungen werden manchmal erst verzögert sichtbar und tun manchmal auch dann erst weh). Wenn euch etwas von der Lösung auf die Haut gerät, spült es gründlich mit fliessendem Wasser ab. Sollte euch trotz aller Vorsicht etwas ins Auge spritzen, spült das Auge sehr gründlich mit fliessendem Wasser aus (10 Minuten lang ist Labor-Standard!) und geht bei Beschwerden zum Augenarzt!
Ausserdem kann Wasserstoffperoxid farbige Textilien bleichen. Der Labormantel bzw. die Malschürze soll eure Kleider davor schützen.
Die „Zahnpasta“ selbst enthält kaum bis kein Wasserstoffperoxid mehr und kann daher gefahrlos angefasst werden.
Entsorgung
Die „Zahnpasta“ und Reste im Reaktionsbehälter können mit viel Wasser in den Abfluss entsorgt werden. Übrige Wasserstoffperoxidlösung könnt ihr im dicht schliessenden Originalbehälter in einem dunklen Schrank aufbewahren und später für weitere Experimente verwenden.
Was passiert da – Wie entsteht die Elefantenzahnpasta?
Wasserstoffperoxid – H2O2 – ist eine recht instabile Verbindung. Unter alltäglichen Bedingungen ohne Reaktionspartner zerfällt es sehr langsam in Wasser und Sauerstoff:
2H_{2}O_{2}\rightarrow 2H_{2}O+O_{2}Kommt Wasserstoffperoxid allerdings mit anderen Stoffen in Berührung, oxidiert es die meisten davon. Das gilt insbesondere für die Bestandteile von Lebewesen. Deshalb solltet ihr bei diesem Experiment Schutzbrille und -kleidung tragen!
Schutz vor Oxidation durch Aufräum-Enzyme
Wenn die Zellen sauerstoffatmender Lebewesen (Menschen, Tiere, Hefepilze,…) Energie aus Sauerstoff gewinnen, kann in ihnen jedoch H2O2 als unerwünschtes Nebenprodukt entstehen (so ausgeklügelt die Reaktionswege sind, fehlerfrei laufen sie noch lange nicht). Damit dieses Wasserstoffperoxid nicht wild herumoxidiert, haben die Zellen ein Aufräumkommando, das durch Fehler entstehendes H2O2 schnellstmöglich aus der Welt schafft.
Dabei handelt es sich um Enzyme mit dem Namen Katalase. Das sind Proteine, die die natürliche Zersetzung von Wasserstoffperoxid in Wasser und Sauerstoff um ein Vielfaches beschleunigen – indem sie den Ablauf der Reaktion erheblich erleichtern.
Ein Biokatalysator erleichtert den Reaktionsablauf
Denn Reaktionen laufen dann leichter ab, wenn weniger Energie nötig ist, um sie zu starten. Ein Stoff, der eine Reaktion beschleunigen kann (ohne selbst abzureagieren), indem er die zum Start der Reaktion nötige Aktivierungsenergie verringern kann, wird Katalysator genannt.
Im Auto ist der Katalysator eine Metalloberfläche, an welcher giftige Abgase zu weniger giftigen Stoffen reagieren (mehr dazu findet ihr hier). In Lebewesen heissen die Katalysatoren Enzyme. Enzyme sind also Proteine, die Reaktionen erleichtern und damit beschleunigen. Die Katalasen gehören unter diesen zu den schnellsten Enzymen überhaupt: Ein einziges Katalase-Molekül schätzungsweise bis zu 10 Millionen H2O2-Moleküle in der Sekunde umsetzen! Das hat zur Folge, dass die Geschwindigkeit des Wasserstoffperoxid-Abbaus mit Katalase praktisch nur davon abhängt, wie viel H2O2 das Enzym in gegebener Zeit „zu fassen“ bekommt.
Gasentwicklung dank Katalase
Damit ist die Katalase bestens geeignet, um durch Fehler in anderen Reaktionsabläufen entstehendes Wasserstoffperoxid sofort wieder verschwinden zu lassen – oder um aus Wasserstoffperoxid, das von aussen eindringt, in kürzester Zeit grosse Mengen Sauerstoff-Gas freizusetzen.
Wenn wir unsere Hefe durch Mischen mit Wasserstoffperoxid-Lösung (relativ) grossen Mengen H2O2 aussetzen, stürmen diese kleinen Moleküle die Hefezellen und werden dort postwendend zu Wasser und Sauerstoff-Gas umgesetzt. Sollten die Zellen dabei platzen oder ihre Aussenwände kaputt oxidiert werden, kommt die Katalase zudem direkt mit der Wasserstoffperoxid-Lösung in Berührung und das Gas entsteht noch schneller.
Nun brauchen gasförmige Stoffe ein Vielfaches mehr an Platz als flüssige Stoffe aus den gleichen Teilchen, sodass sich das Sauerstoff-Gas sehr schnell ausdehnt. Da unser Gemisch aber Seife enthält, werden die entstehenden Sauerstoffportionen in winzige Seifenbläschen eingeschlossen (über diese und andere Superkräfte von Seife könnt ihr hier nachlesen): Es entsteht Schaum.

Und dieser Schaum, nass von Seifenwasser und Hefezellresten, quillt als „Elefantenzahnpasta“-Schlange aus dem Gefäss heraus.
Zusammenfassung
Die „Elefantenzahnpasta“ besteht also aus Schaum aus Seife und Sauerstoff, der durch „Überfütterung“ der Oxidationsschutz-Enzyme von Hefezellen mit Wasserstoffperoxid entsteht.
Auch Menschenzellen haben Katalasen, die den Abbau von Wasserstoffperoxid in der gleichen Weise beschleunigen: Wenn Wasserstoffperoxid in unsere Haut gelangt, entstehen im Gewebe kleine Sauerstoffbläschen, welche wir als die weissen Verletzungen sehen können.
Wichtig: Die Schutzenzyme des Körpers sind genau darauf ausgelegt, solche Oxidationsmittel zu entfernen, die bei Fehlern in zelleigenen Prozessen entstehen. Andere Oxidations- und Bleichmittel, insbesondere unter dem Kürzel „MMS“ als „Wunderheilmittel“ vertriebene gefährliche Chlorverbindungen gehören da nicht zu! Gegen solche Stoffe hat der menschliche Körper keine eigenen Schutzmassnahmen!
Und habt ihr das Elefanzenzahnpasta-Experiment schon einmal ausprobiert? Wozu sonst verwendet ihr Wasserstoffperoxid?
Hast du das Experiment nachgemacht:
[poll id=“10″]
Wenn etwas nicht oder nur teilweise funktioniert haben sollte, schreibt es in die Kommentare. Ich helfe gerne bei der Fehlersuche!










