In diesen Wochen dreht sich alles um 22 Kerle auf dem Rasen: Der Ball ist rund, und das Spiel dauert 90 Minuten – In Frankreich beginnt diese Woche die Fussball-Europameisterschaft.
Was aber hat das mit Geschichten um Chemie und Co zu tun?
Auch die Chemie hat ihren Beitrag zum Fussball-Fieber geleistet – und zwar nicht in einer Labor-Küche eines verrückten Chemikers, sondern in der Natur selbst!
Wahrscheinlich kennt jeder die beiden häufigsten Erscheinungsformen von Kohlenstoff – Diamant und Graphit. Ersterer ist bekanntlich der beste Freund eines jedes Mädchens und als funkelnder Schmuckstein heiss begehrt. Letzterer ist vor allem Zeichnern und anderen Skizzenblock-Liebhabern teuer, welche mit ihrem Bleistift kein Blei auf ihrem Papier verteilen, sondern Kohlenstoff in Form von Graphit (deshalb sollte das Zeichengerät eigentlich Graphitstift heissen…).
Dass auch der Fussballgott Gefallen an diesem Element gefunden hat, ist unter Fussballfans allerdings weniger bekannt:
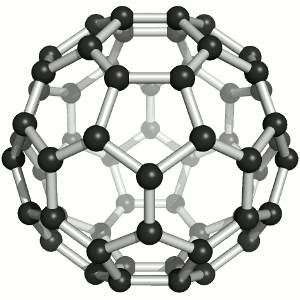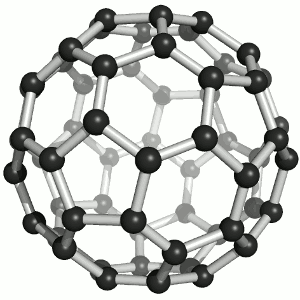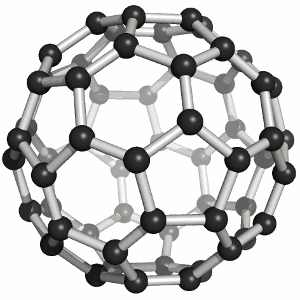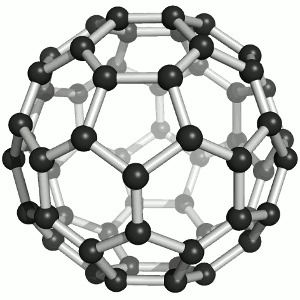
Das Bild zeigt ein Molekül aus 60 Kohlenstoff-Atomen, das tatsächlich wie ein Fussball aussieht! Oder eben, wie ein Fussball Anno dazumal aussah. So, wie das runde Leder dereinst eigentlich 60 Ecken hatte, hat das Molekül 60 Kohlenstoff-Atome, die in Fünf- und Sechsecken angeordnet sind, wie die Lederflächen des guten alten Sportgeräts. Und dieses Molekül heisst „Fulleren“ (man betone ganz chemikermässig auf der letzten Silbe), genauer Buckminster-Fulleren, im Englischen auch „buckyball“ oder „footballene“ (das ebenso betont wird wie „Fulleren“).
Wie kommt das Fussballmolekül an seinen Namen?
Das internationale Chemie-Namensgeber-Gremium IUPAC hatte für den Kohlenstoff-Fussball ursprünglich einen Namen gemäss seiner eigenen Namens-Regeln vorgesehen:
Hentriacontacyclo[29.29.0.02,14.03,12.04,59.05,10.06,58.07,55.08,53.09,21.011,20.013,18.015,30.016,28.017,25.019,24.022,52.023.50.026,49.027,47.029,45.032,44.033,60.034,57.035,43.036,56.037,41.038,54.039,51.040,48.042,46]hexaconta-1,3,5(10),6,8,11,13(18),14,16,19,21,23,25,27,29(45),30,32(44),33,35(43),36,38(54),39(51), 40(48),41,46,49,52,55,57,59-triaconten …
Da zeigen selbst Wissenschaftler die rote Karte: Viel zu kompliziert! Weil die Chemiker, die über solche Moleküle sprechen, jedoch findig sind, haben sie dieses Molekül nach dem benannt, woran sein Anblick sie erinnerte. Nein, zunächst nicht nach dem Fussball, sondern nach den futuristischen, netzartigen Kugel- und Kuppelgebäuden des Architekten Richard Buckminster Fuller. Dessen Nachname, mit der Chemikernachsilbe „-en“ für Kohlenstoff-Verbindungen mit C-C-Doppelbindungen versehen, diente den Chemikern so lange als Behelfsname für die Kohlenstoff-Bälle, bis die IUPAC 2002 schliesslich nachgab und den Namen offiziell anerkannte.

„Biosphère“ – erbaut von Richard Buckminster Fuller zur Expo 1967 in Montreal
Warum nun Fuller-en und nicht Football-en? Tatsächlich ist der chemische Fussball nur das erste einer ganzen Reihe in sich geschlossener Kohlenstoff-Moleküle, die eher wie missglückte Versuche der Fussball-Erschaffung wirken. So erinnert das nächste Molekül der Reihe, C70, eher an einen Rugby-Ball, denn an den perfekt symmetrischen europäischen Fussball:
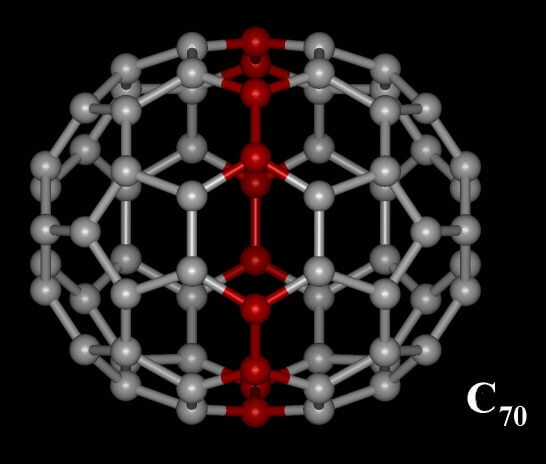
[70]Fulleren (ausgesprochen „Siebzig-Fulleren“ – die 10 zusätzlichen C-Atome, die den „Fussball“ [60]Fulleren zum Rugby-Ball ergänzen, sind rot dargestellt (by Ptj [CC BY-SA 3.0], via Wikimedia Commons
Als Fullerene werden jedoch alle Moleküle dieser Reihe bezeichnet. Einzig der „wahre“ Fussball unter ihnen, C60 bzw. [60]Fulleren, trägt auch den zweiten Vornamen Fullers, was ihn zum „Buckminsterfulleren“ macht. Und natürlich gebührt nur diesem Exemplar der Spitzname „footballen“.
Wie sieht der Stoff [60]Fulleren aus?
Ich hatte im letzten Herbst Gelegenheit, eine Glasphiole mit etwa einem halben Fingerhut voll [60]Fulleren in der Hand zu halten. Und obwohl ich dies als Chemikerin und langjähriger Fan dieser besonderen Laune der Natur als ganz besonderen Augenblick empfand, ist der Stoff, der aus C60-Molekülen besteht, äusserlich recht unspektakulär.
Im Grunde genommen handelt es sich dabei nämlich um ein schwarzbraunes Pulver, dessen Partikel, wenn sie gross genug sind, metallisch glänzen können. Dafür war meine Probe allerdings zu feinkörnig – und sah daher nicht anders aus als ein wenig gesammelter Russ. Und dafür ist reines [60]Fulleren doch ziemlich teuer: Wohl nicht umsonst trug jene Phiole aus der Sammlung eines Zürcher Gymnasiums ein dickes Preisschild „CHF 100.-“ (beim Chemikalienhändler meines Vertrauens gibt es 1 Gramm [60]Fulleren derzeit für rund 300 CHF) – so wird niemand auf die Idee kommen, das „Bisschen Russ“ unsanft zu behandeln oder gar zu entsorgen.

Kristalle aus [60]Fulleren (By Fotograf: Jochen Gschnaller [GFDL or CC-BY-SA-3.0], via Wikimedia Commons)
Ihre wahre Farbenpracht entfalten die Fussball-Moleküle jedoch, wenn man sie in einem organischen Lösungsmittel löst. In Toluol beispielsweise erscheint [60]Fulleren leuchtend purpurrot.
Warum kann es Fussballmoleküle überhaupt geben?
Wer sich an die Schule (oder gar sein Studium) erinnert, mag noch wissen, dass Kohlenstoff eigentlich vier Bindungen eingeht. Diese räumlichen Gebilde lassen sich praktisch beliebig zu Ketten, Ringen oder ganzen Netzwerken verknüpfen und ermöglichen so die schier unendlich grosse Vielfalt der Kohlenstoff-Chemie.
Die C-Atome im Fussball haben aber nur je drei Bindungen! Zumindest nur drei, deren Anordnung man klar festlegen kann. Das jeweils vierte Valenz-Elektron jedes C-Atoms, welches sonst an der vierten Elektronenpaarbindung teilhat, ist hingegen frei auf der Balloberfläche beweglich.
Diese Elektronen-„Aussenhaut“ verschafft dem [60]Fulleren ganz besondere Eigenschaften. Für Zeichner von Lewis-Formeln, jenen Darstellungen von Molekülen, die aus Elementsymbolen und Strichen für Elektronenpaare bestehen, erweisen sich bewegliche Elektronen jedoch als ziemlich lästig. Schliesslich weiss man nie so genau, wo man sie hinzeichnen soll.
Eine Lösung dieses Problem besteht darin, zwei oder mehrere Versionen eines Moleküls darzustellen und die beweglichen Elektronen einmal hier, einmal dort als zusätzliche Bindung einzuzeichnen.

Darstellung des Ozon-Moleküls durch mesomere Grenzformeln
Solche Versionen eines Moleküls, die jedes für sich eine extreme Anordnung der beweglichen Elektronen zeigen, heissen „mesomere Grenzformeln“. Das hier gezeigte Ozon lässt sich mit zweien davon darstellen – würde man sie mitteln, könnte man sagen: Je zwei Sauerstoffatome im Ozon sind über eineinhalb Bindungen miteinander verknüpft.
Was beim Ozon noch sehr überschaubar ist, würde beim [60]Fulleren auch den grössten Fussballfan unter den Chemikern in den Wahnsinn treiben: Um den Kohlenstoff-Fussball vollständig mit mesomeren Grenzformeln darzustellen, müsste man ihn auf 12500 verschiedene Weisen zeichnen! Denn nur so bekommt man alle möglichen Extreme für die Anordnung der beweglichen Elektronen an den „Kanten“ des Fussballs zusammen. Deshalb stellen die Chemiker, wenn sie den C60-Fussball als Lewis-Formel zeichnen, meist die Stabilste der 12500 Möglichkeiten dar: Alle Doppelbindungen befinden sich darin an den Kanten der Sechsecke, während die Fünfecke leer ausgehen.
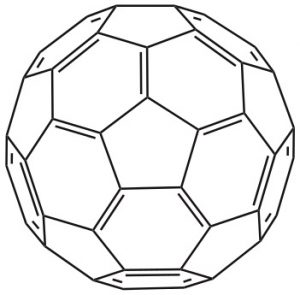
Stabilste Grenzformel für den „Fussball“ [60]Fulleren (der Übersicht zuliebe sind nur die Bindungen der Vorderseite des Balls dargestellt!)
Ohne diese grossen Umstände, die der Kohlenstoff-Fussball den Chemikern beim Zeichnen macht, gäbe es dieses Molekül jedoch nicht. Das kann rasch nachvollziehen, wer versucht, einen C60-Fussball aus den vorgefertigten Teilen eines Molekülbaukastens zusammen zu setzen. Denn gleich ob man C-Atome mit vier oder mit drei Bindungen wählt – wirklich ein Fussball sein wollen die alle nicht: Das Gebilde steht spätestens bei der Fertigstellung gehörig unter Spannung.
Das gilt auch für die echten Kohlenstoff-Atome, welchen die Bausteine im Molekülbaukasten nachempfunden sind. Auch das [60]Fulleren-Molekül steht unter Spannung. Das heisst, es enthält eine ganze Menge Energie. Und viel Energie bedeutet in der bequem veranlagten Natur, die stets einem energieärmsten Zustand entgegen strebt, dass so ein Molekül nicht sehr stabil ist.
Andererseits sind bewegliche Elektronen in Sachen Energiegehalt besonders günstig. So bedeutet die Möglichkeit, mehrere mesomere Grenzformeln für ein Molekül zeichnen zu können, auch, dass dieses besonders stabil ist (die Chemiker nennen diesen Umstand „Mesomerie-Stabilisierung“).
Rechnet man all das zusammen, erweist sich die Aussenhaut des C60-Fussballs aus Elektronen als so günstig, dass der Ball trotz innerlicher Spannung stabil ist. Und zwar so stabil, dass Chemiker an dessen Oberfläche weitere Atomgruppen anbringen und das Ganze auf eine Reise durch einen lebenden Organismus schicken können, ohne dass der Ball dabei Schaden nimmt!
Wo kommt das Fussballmolekül natürlich vor?
So exotisch ein fussballförmiges Molekül wirken mag, ist es doch eine ganz alltägliche Sache. Man entzünde eine Kerze (möglichst eine, die ordentlich russt) und halte einen kühlen Löffel oder ein ebenso kühles Stück Porzellan direkt über die Flamme (Achtung: Löffel oder Porzellan mit Tiegelzange, Holzwäscheklammer oder ähnlichem festhalten – das Teil wird heiss!) – und wenn es schön schwarz wird: Herzlichen Glückwunsch zum selbst hergestellten Fulleren!
Natürlich enthält der Russ die Fussbälle und ihre grösseren Verwandten in keiner irgendwie verwertbaren Menge – daneben gibt es noch genügend andere Kohlenstoff-Trümmer – aber ein paar Exemplare sind ganz bestimmt mit dabei.
Aber nicht alle Fussbälle der Natur sind uns so nah. Im Jahr 2010 haben Wissenschaftler mit Hilfe des Weltraumteleskops Spitzer die Existenz von C60 und C70 im planetarischen Nebel Tc 1 nachgewiesen (im Infrarot-Spektrum eines solchen Überrests einer Nova lassen sich Informationen über darin enthaltene Moleküle ablesen). Diese Fullerene haften – das verraten die aufgenommenen Spektren ebenfalls – an Staubteilchen, aus welchen solch ein Nebel besteht. Von der Erde aus hatte man die Weltraum-Fussbälle bis anhin nicht gesehen, weil sie sich laut Prof. Paul Scheier von der Universität Innsbruck vermutlich unter einer Hülle aus Wasserstoff-Moleküle verbergen. Und um die zu durchdringen, bedarf es eines Teleskops ausserhalb jeglicher störender Atmosphäre – eben ein Weltraum-Teleskop.
Einfacher ist es da, die Fussball-Moleküle auf der Erde zu suchen. Das Gestein Shungit, das bis zu 98% aus reinem Kohlenstoff besteht, enthält nachweislich C60 und C70. Mineralienfans haben den Kohlenstoff-Fussball sogar als Mineral – Fullerit – beschrieben. Allerdings hat die International Mineralogic Association IMA, welche die Regeln der Mineralienkunde festlegt, anscheinend nicht viel fürs runde Leder (oder kaum in Reinform natürlich auftretende Stoffe) übrig, sodass dieser Anlauf zurückgewiesen wurde. Ob mit oder ohne Mineralstatus – um das Fussball-Gestein zu finden, muss man sich nicht in den Weltraum, sondern nur nach Ostfinnland, Russland oder Indien aufmachen. Und wem selbst das zu weit ist, der kann Shungit vielerorts als Schmuckstein erstehen.

Shungit-Rohsteine in Karelien, Russland (By Amrith.de (Own work) [GFDL or CC BY 3.0], via Wikimedia Commons)
Darüber hinaus „russt“ es auf der Erde meist dort, wo es in der Natur gewaltig kracht. So sind Fullerene beispielsweise in Fulgurit – durch Blitzschläge in Sand oder Gestein zusammengeschmolzenen Glasgebilden – oder in Einschlag-Kratern von Meteoriten nachgewiesen worden.
Wer allerdings mehr mit den Fussbällen anfangen möchte, als ihre Existenz nachzuweisen und sie zu vermessen, wird die dazu nötigen Mengen allerdings technisch aufwändig selbst herstellen müssen. Denn auf der Erde sind die Fullerene zu selten, als dass sich ein Abbau irgendwo lohnen würde.
Was kann man mit Fussballmolekülen eigentlich machen?
Ebenso exotisch, wie der Kohlenstoff-Fussball aussieht, erscheinen auch viele seiner Anwendungen. Manches klingt sehr nach Star Trek, doch was ich hier zusammengetragen habe, wird – mindestens im Labor, zuweilen auch schon in der Welt „draussen“ – bereits gemacht:
Fussbälle als Atomfallen
Wie richtige Fussbälle sind auch Fulleren-Moleküle innen hohl: Der Innendurchmesser des Fussballs C60 beträgt etwa 700pm (Picometer, Billionstel Meter). Das ist genug, um ein ganzes einzelnes Atom (ein Helium-Atom hat beispielsweise einen Durchmesser von 280pm) darin unterzubringen, wie in einem Käfig! Für Atome im Fussball haben die Chemiker eine Schreibweise erfunden, die ein wenig an eine Email-Adresse erinnert: Für ein Helium-Atom im Fussball-Käfig lautet sie beispielsweise He@C60.
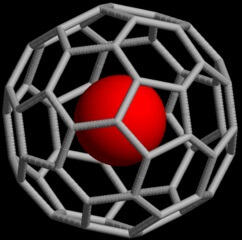
He@C60 : Ein einzelnes Atom (rot) ist vollständig vom Kohlenstoff-Käfig umschlossen (By Hajv01 (Own work) [GFDL or CC BY-SA 4.0-3.0-2.5-2.0-1.0], via Wikimedia Commons)
Das Einsperren von Edelgas-Atomen (das Markenzeichen der Edelgase ist, dass sie chemisch äusserst reaktionsträge sind und normalerweise aus einzelnen Atomen bestehen) ist wohl nur eine Frage des Platzes im Fussball – und der technischen Möglichkeiten, ein Atom in das Innere des Balls zu befördern. Es geht aber noch weitaus abgefahrener:
Das Ganze funktioniert nämlich auch mit einzelnen Stickstoff-Atomen! Stickstoff kommt normalerweise in Molekülen aus je zwei Atomen vor, die über drei Bindungen fest miteinander verknüpft sind (was auch das Gas Stickstoff ziemlich reaktionsträge macht). Einzelne Stickstoff-Atome sind hingegen hoch reaktiv – es sei denn, es gelingt, solch ein Stickstoff-Atom in ein Fulleren einzusperren: N@C60 ist so stabil, dass das Stickstoff-Atom keinerlei Einfluss auf die Fussball-Hülle, geschweige denn auf die Welt jenseits davon hat. So können Wissenschaftler dank des Fussball-Käfigs einzelne Atome vollkommen abgeschirmt von ihrer Umgebung untersuchen, was unter natürlicheren Bedingungen undenkbar wäre.
Fussbälle als Supraleiter
Fussball-Moleküle sind grosszügig: Sie nehmen sehr leicht zusätzliche Elektronen in ihre „Aussenhaut“ auf.
So können sie beispielsweise mit Alkalimetallen wie Natrium oder Kalium zu besonderen Salzen reagieren, die Fulleride genannt werden. Die Kristalle solcher Verbindungen leiten den elektrischen Strom – und mehr noch: wenn man sie auf genügend niedrige Temperaturen abkühlt, leiten sie den Strom praktisch ohne Widerstand! Solche Stoffe nennen die Physiker „Supraleiter“ – und Fulleride gehören, da sie schon bei relativ „warmen“ Temperaturen von 40 Grad über dem absoluten Nullpunkt supraleitend werden können, zu den „Hochtemperatur-Supraleitern“. Überragend sind die Fullerene in diesem Gebiet dennoch nicht, da bereits zeitgleich mit der Entdeckung der Molekül-Fussbälle Mitte der 1980er Jahre Hochtemperatur-Supraleiter aus anderen Materialien entdeckt wurden, die man heutzutage schon ab über 100 Grad über dem absoluten Nullpunkt zum Supraleiten bringt.
Fussbälle als Lebenselixier?
Ihre grosszügige Bereitschaft Elektronen aufzunehmen befähigt die Kohlenstoff-Fussbälle dazu, reaktive Teilchen in ihrer Umgebung geradezu schwammartig „abzusaugen“. Die gefürchtetsten unter diesen reaktiven Teilchen sind sogenannte Radikale – Atome oder Moleküle, die mindestens ein einzelnes Elektron tragen und sich für dieses mit geradezu radikalen Methoden Reaktionspartner zu suchen pflegen. Und damit machen sich Radikale besonders in lebenden Zellen und Geweben, in welchen sie viele Biomoleküle schädigen können, reichlich unbeliebt.
Da liegt es nahe, Fullerene zur Vorbeugung von Krankheiten, die von Zellschäden durch Radikale herrühren (wie zum Beispiel degenerative Nervenerkrankungen wie Alters-Demenz) einzusetzen. Der Haken an der Sache: Das Fussball-Molekül als solches ist nicht wasserlöslich. Deshalb wird eifrig an Methoden geforscht, um die Bälle mit zusätzlichen, wasserlöslichen Atomgruppen zu bestücken.
Bereits eingesetzt werden die die Kohlenstoff-Fussbälle in Anti-Aging-Kosmetik, wo sie die Aufgabe von Vitamin E mit übernehmen sollen: Radikale abfangen, die sonst zur Hautalterung beitragen würden. Da es betreffend einer Giftigkeit oder Nicht-Giftigkeit der Fullerene jedoch nicht genügend Daten gibt, gehen die Meinungen zum Jungbrunnen in Fussballform jedoch ziemlich auseinander.
Fussbälle gegen Krebs und AIDS?
Der zweite Haken an der Sache folgt nämlich auf dem Fuss: Unter den passenden Umständen können Fussball-Moleküle auch zur Entstehung von reaktiven Teilchen beitragen. Bei Bestrahlung mit Licht können Fullerene in Gegenwart von Sauerstoff sogenannten „Singulett-Sauerstoff“ erzeugen, eine ausgesprochen energiereiche Variante des Sauerstoff-Moleküls, welche wiederum Moleküle in seiner Umgebung angreifen kann.
Das macht viele Fulleren-Verbindungen zu regelrechten Zellgiften. Die können jedoch sehr gezielt, beispielsweise gegen Krebszellen, eingesetzt werden, indem man die Fussbälle zuerst in die Zellen hineinbringt und dann den Tumor bestrahlt. In Studien an Zellkulturen und Mäusen funktioniert das zumindest vielversprechend.
Eine weitere bekannte „Nebenwirkung“ von Fullerenen besteht darin, dass sie verschiedene Enzyme hemmen können, wie Sand ein Getriebe blockiert. Unter diesen Enzymen ist die HIV-1-Protease, welche unerlässlich für die (zweifellos unerwünschte) Funktion des HI- bzw. AIDS-Virus ist. So gilt der vielseitige Kohlenstoff-Fussball auch als vielversprechende Option im Kampf gegen HIV und andere Viren.
Fussbälle in Solarzellen
Die Herstellung von Strom in Solarzellen beruht im Prinzip auf der räumlichen Trennung von positiven (Atomrümpfen) und negativen (Elektronen) elektrischen Ladungen mit Hilfe von Lichtenergie. Dazu verwendet man heutzutage meist anorganische Halbleiter, in der Regel Silicium. Es gibt jedoch bereits ebenso Solarzellen aus organischem Material, in welchen die vielseitigen Fullerene als Elektronen-Sammler wertvolle Dienste leisten. Solche Solarzellen erscheinen äusserlich wie eine Kunststoff-Folie, also dünn, biegsam und zuweilen sogar durchsichtig! Einzig was den Wirkungsgrad betrifft, haben die organischen Solarzellen gegenüber ihren anorganischen Verwandten noch aufzuholen.
Fussbälle als….?
Die Liste von Verwendungsmöglichkeiten für das Fussball-Molekül und seine Verwandten liesse sich noch weiter fortsetzen. Und falls nun jemand auf die Idee kommen wollte, einen C60-Fussball zu dem zu verwenden, was man mit einem Fussball normalerweise tut – nämlich Fussball spielen: Ein passendes Material für Fussballtore im Nanoformat ist ebenfalls schon erfunden. Es nennt sich Graphen – und ist ein flaches, nur einen Atomdurchmesser dickes Netz aus Kohlenstoffatomen, die zu sechseckigen Maschen verknüpft sind….aber das ist eine andere Geschichte.
Vom kleinen zum grossen Fussball
Es bleibt abzuwarten, ob wir die Spiele der EM 2020 vielleicht schon im mit einem runden, fussballförmigen Solarpaneel betriebenen Fernseher verfolgen können, unser Lieblings-Sportgerät im Kleinformat vom Arzt verschrieben bekommen oder ganz neue Einsatzmöglichkeiten für den Superfussball finden werden.
Schon jetzt wohlbekannt ist hingegen wohl jedem, wie es in 2016 in der makroskopischen Welt zu laufen hat: Das Runde gehört in das Eckige. Und das so oft wie möglich auf der richtigen Seite. In diesem Sinne: Hopp Schwiiz!
Und seid ihr dem Fussball-Molekül auch schon einmal begegnet? Oder war euch diese sportliche Laune der Natur bislang völlig unbekannt?










