Eigentlich will ich mich ja gegen die Grippe impfen lassen… aber eine wirklich penetrante Erkältung lässt mich (noch) nicht. Während die ausheilt habe ich Zeit, mich zu fragen: Was ist eigentlich in so einem Grippe-Impfstoff drin?
Die Frage kommt nicht von ungefähr, sind doch Impfungen einmal mehr in aller Munde. Nicht nur die Grippesaison steht vor der Tür. Zudem macht Deutschland mit dem Beschluss einer Impfpflicht gegen die Masern von sich reden.
Heute möchte ich aber vornehmlich beim Grippeimpfstoff bleiben, der einerseits ein spezieller Fall in der Impfstoff-Familie ist, andererseit aber als Beispiel für andere Impfstoffe herhalten mag.
Warum ist der Grippeimpfstoff speziell?
Letztlich aufgrund seiner eingeschränkten Wirksamkeit. Die beruht darauf, dass Grippeviren ganz besonders fiese Arschlöcher sind. Die mutieren nämlich schneller zu immer neuen Stämmen, als die Forscher Impfstoffe gegen sie entwickeln können (wie genau sie das machen, erklärt Mai Thi sehr gut in ihrem aktuellen Video).
So müssen Forscher schon zu Anfang eines neuen Jahres Vermutungen anstellen, wie der fieseste Grippevirus – besser die fiesesten Grippeviren – der kommenden Saison aussehen mögen. Denn Entwicklung, Herstellung und Erprobung einer neuen Impfstoff-Variante dauern gut ein halbes Jahr. Und danach können die Forscher nur hoffen, dass die tatsächlich grassierenden Viren den vermuteten zumindest ähnlich sind.
Anders als die Impfstoffe gegen Masern und andere Kinderkrankheiten, die nahezu immer schützen, bietet eine Grippeimpfung damit nur eingeschränkt Schutz gegen Grippe. Wenn es aber darum geht, ob man eine Woche statt drei Wochen flach liegt, ins Spital muss oder nicht bzw. mit einer massgeblich geringeren Wahrscheinlichkeit krank wird, lohnt sich die Impfung allemal. Auch jedes Jahr aufs Neue. Besonders, wenn man zu einer der Risikogruppen zählt, die das Schweizerische Bundesamt für Gesundheit nennt.
Die Grippeimpfung ist übrigens auch für Kinder einschliesslich Säuglingen ab 6 Monaten möglich. Und wenn die Kinder in die Krippe, den Kindergarten oder die Schule gehen, mag die Impfung sich für sie ebenso lohnen wie für ihre Lehrer und Erzieher.
Anbei: Für die aus medizinischen Gründen Gefährdeten (Senioren, Bewohner von Pflegeheimen, Kranke, Schwangere, Frühgeborene) übernimmt in der Schweiz die obligatorische Krankenversicherung die Kosten für die Impfung.
Aber was ist nun drin im Impfstoff?
In Impfkritiker-Kreisen kursieren zahllose Gerüchte um Quecksilber, Aluminium und andere angeblich fiese Hilfsstoffe, ganz zu schweigen von angeblich unsicheren Wirkstoffen.
Dabei lassen sich im Netz ziemlich einfach Fachinformationen mit genauen Inhaltsstofflisten im Netz auftreiben. Zum Beispiel im Arzneispezialitätenregister des Österreichischen Bundesamts für Sicherheit im Gesundheitswesen. Das einzige, was man dafür braucht, ist der Handelsnahme eines Impfstoffs.
Den habe ich mir aus einer Broschüre des Schweizerischen Bundesamtes für Gesundheit herausgepickt. Der Umstand, dass ich einen in der Schweiz gebräuchlichen Impfstoff in der österreichischen Datenbank gefunden habe, lässt mich darauf schliessen, dass solche Impfstoffe im DACH-Raum grenzübergreifend zum Einsatz kommen. Was jetzt kommt, wird demnach auch für Impfstoffe in Deutschland gelten.
Mein Beispiel-Impfstoff ist Fluarix Tetra®, zugelassen für Kinder ab drei Jahren und Erwachsene. Dieser Impfstoff kommt übrigens seit Jahren mit jeweils angepassten Virenstämmen zum Einsatz. Darin sind enthalten:
Inaktivierte Influenza-Virus Spaltantigene
Das ist der eigentliche „Wirkstoff“ im Impfstoff, welcher das Immunsystem veranlassen soll, die Informationen über die gefährlichen Grippeviren zu speichern. Wie das Immunsystem arbeitet und wie das genau funktioniert, könnt ihr übrigens hier in Keinsteins Kiste nachlesen.
Aber was bedeutet dieser Fachausdruck eigentlich?
Um das Immunsystem zur Informationsverarbeitung zu veranlassen, müssen ihm Krankheitserreger „vorgeführt“ werden. Damit der Körper dabei aber nicht krank wird, müssen diese Erreger entweder in einer abgeschwächten („zahnlosen“) Version daher kommen (das nennt man dann einen Lebendimpfstoff), oder man führt dem Immunsystem funktionslose Bruchstücke der Erreger vor (als Totimpfstoff).
Um solche Bruchstücke herzustellen, züchten die Entwickler in speziellen Labors Grippeviren und zerlegen sie dann in ihre Bestandteile. Dabei lösen sie unter anderem Proteine (die fiesen „Stacheln“, die in vielen Virus-Darstellungen zu sehen sind) aus der Aussenhülle der Viren, trennen sie vom Rest und packen sie in den Impfstoff.
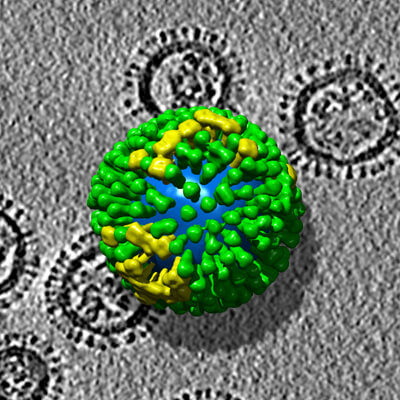
An diesen Proteinen erkennt nämlich unser Immunsystem die Viren. Nur – die Proteine allein, ohne Virenhülle und vor allem ohne Virenerbgut, können keine Grippe verursachen.
Moleküle, die unser Immunsystem erkennt, werden nun Antigene genannt. Da unsere Antigene bei ihrer Herstellung von Viren „abgespalten“ wurden, sprechen die Entwickler von Spaltantigenen. Und da sie allein keine Grippe („Influenza“) mehr verursachen können, sind diese Spaltantigene „inaktiviert“.
Wie züchtet man Grippeviren?
Viren können sich nicht selbst vermehren (und sind damit nach landläufiger Definition der Biologen keine Lebewesen), sondern müssen dazu lebende Zellen befallen und deren Vermehrungsanlagen kapern. Deshalb sind zur Virenzucht lebende Wirtszellen nötig.
In den 1960er Jahren haben Forscher dafür geeignete Zellen in befruchteten Hühnereiern entdeckt. Darin wachsen nämlich nebst dem Küken auch verschiedene blasenartige Hilfsorgane. Und die Zellen von deren Aussenhäuten sind offenbar besonders gut geeignet, um in kurzer Zeit viele Grippe- und andere Viren herzustellen. Und zwar so gut, dass man diese Methode bis heute verwendet:
Befruchtete Hühnereier werden 10 bis 11 Tage lang im Brutschrank bebrütet. Dann wird durch ein kleines Loch in der Schale der gewünschte Virenstamm in das Anhangsorgan eingebracht und drei Tage lang weiter bebrütet. In dieser Zeit vermehren sich die Viren sehr stark und gelangen in die Flüssigkeit im Innern „ihres“ Wirtsorgans. Dann wandern die Eier für einige Stunden in den Kühlschrank, sodass die Embryonen darin absterben (ich habe mir ja sagen lassen, dass der Tod durch Unterkühlung eine schmerzlose Angelegenheit sein soll, aber probiert habe ich es nicht), ehe die Flüssigkeit samt Viren entnommen wird.
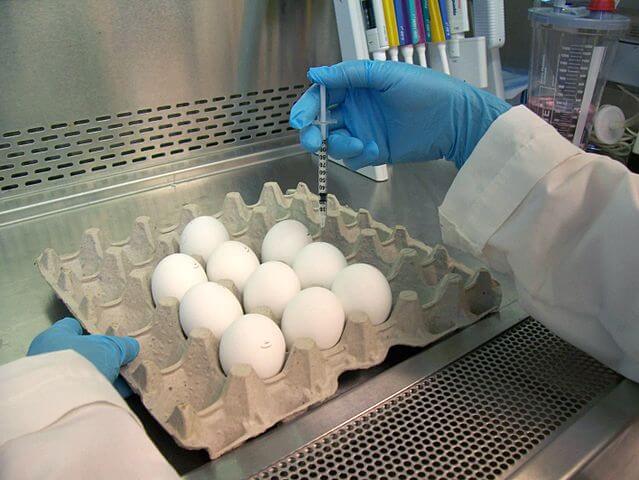
Es folgt das Zerlegen („Inaktivieren“) der Viren mit Hilfe von speziellen Tensiden (Stoffen mit Superwaschkraft – diese können Proteine aus Virushüllen „waschen“, ohne dass die Proteine babei beschädigt werden!) und die Reinigung des Ganzen, damit am Ende nur in der Impfdosis landet, was dort hinein soll.
Moment – dabei sterben doch Tiere?!
Ja, das ist bis dato leider unvermeidbar, wenn wir uns vor der Grippe schützen möchten. Denn einen anderen Schutz vor der Grippe gibt es – besonders für irgendwie geschwächte Menschen – aktuell nicht.
Natürlich ist man heute schon weiter als vor sechzig Jahren und kann Viren auch in Zellkulturen züchten. Bloss funktioniert das mit Grippeviren nicht besonders gut. Die Ausbeuten an Grippeviren aus Zellkulturen sind so schlecht, dass es im Normalfall viel zu teuer wäre, die gewünschte Impfstoffmenge auf diese Weise herzustellen.
Warum Grippe-Impfstoffe manchmal knapp werden
Einzig wenn ein besonders ansteckender oder/und gefährlicher Grippe-Stamm auftritt und besonders flächendeckend geimpft werden soll, können die Entwickler nicht genügend Eier für die Zucht auftreiben und müssen auf die teureren Zellkulturen ausweichen. Doch dabei gibt es ein neues Problem:
Zum Arbeiten mit besonders ansteckenden („pandemischen“) Grippe-Viren braucht man ein Labor der Sicherheitsstufe (BSL) 3. Und die haben viele Eier-Labors nicht. So bleiben die Produktionsmöglichkeiten auch unabhängig von den Kosten beschränkt.
Aber: Abhilfe ist bereits in Sicht
Da die Forscher jedoch weder Tiere töten noch Engpässe bei der Auslieferung wollen, arbeiten sie fleissig an neuen Möglichkeiten für die Virenzucht. Wie zum Beispiel in Münster mit Wimperntierchen (das sind Einzeller) als Wirten. Vielleicht gibt es ja schon ab 2025 eine wirtschaftliche Alternative zu den Hühnereiern.
Anorganische Salze
Davon finden sich in Fluarix Tetra® eine ganze Reihe:
- Natriumchlorid, NaCl (das „Kochsalz“)
- Natriummonohydrogenphosphat, Na2HPO4
- Kaliumdihydrogenphosphat, KH2PO4
- Kaliumchlorid, KCl
- Magnesiumchlorid, MgCl2 * 6 H2O
Alle diese Salze sind im Impfstoff in Wasser aufgelöst, sodass letztendlich folgende Ionen im Impfstoff enthalten sind: Na+, K+, Mg2+, Cl–, HPO42-, H2PO4– (und für alle Chemiker, die es ganz genau nehmen, sind in verschwindender Menge auch PO43- und Phosphorsäure H3PO4 zu erwarten). Jedes dieser Ionen ist natürlicher Bestandteil praktisch jeder Körperflüssigkeit.
Die beiden Phosphat-Ionen ergeben zusammen einen Phosphat-Puffer, der dafür sorgt, dass der pH-Wert des Impfstoffs irgendwo zwischen 6 und 8 – also im „biologietauglichen“ Bereich – stabil bleibt. So werden die Virus-Proteine darin nicht durch pH-Abweichungen beschädigt – und der pH-Wert des Impfstoffs passt weitgehend zu dem des Muskels, in welchen er gespritzt werden soll.
Die übrigen Ionen sorgen vermutlich dafür, dass die Impfstoff-Flüssigkeit einer Körperflüssigkeit ähnlich ist (sodass nach der Injektion z.B. kein ungewollter osmotischer Druck entsteht (was der anrichten kann, könnt ihr mit diesen Experimenten – mit Ei, aber ohne Küken – erfahren)).
RRR-alpha-Tocopherolhydrogensuccinat
Oder mit anderen Worten: Vitamin E. Also ein alter Bekannter aus der Ernährung und Hautpflege, der für seine Wirkung als Antioxidans bekannt ist. Das heisst, Vitamin E reagiert gern mit Stoffen, die sonst andere Bestandteile unseres Körpers oxidieren und für Stress in unseren Zellen sorgen würden.
Und ausserhalb des Körpers kann es ebenso gut mit Stoffen reagieren, die sonst Virenproteine und andere Impfstoff-Bestandteile kaputt oxidieren könnten. Damit ist das Vitamin E der einzige Konservierungsstoff (nagut, ausser dem Phosphatpuffer), den ich auf der Liste gefunden habe!
Polysorbat 80 („Tween 80“) und Octozinol 10 („Triton 100“)
Zwei der speziellen Tenside, die mit ihrer Superwaschkraft die Proteine aus den Virenhüllen lösen können. Da die Hüllen von Grippeviren aus fettähnlichen Stoffen (Lipiden) bestehen, sind Proteine, die daraus entfernt werden, naturgemäss nicht sehr scharf darauf, sich in Wasser zu lösen (fettfreundliche Stoffe mischen sich nicht mit Wasser und wasserfreundliche Stoffe nicht mit Fetten!).
Da die genannten Tenside – im Grunde spezielle „Seifen“ – nicht weitestgehend aus dem Impfstoff entfernt werden, vermitteln sie dort wohl auch weiterhin zwischen Proteinen und Wasser und sorgen so dafür, dass alle Bestandteile des Impfstoffs sich miteinander mischen.
Auf Lebensmittelpackungen werden solche Stoffe als „Emulgatoren“ vermerkt. Tatsächlich ist Polysorbat 80 als Lebensmittelzusatzstoff (E 433) zugelassen, da es chemisch wie biologisch als weitgehend reaktionsträge gilt. Ausserdem zählt es zu den wenigen Emulgatoren, die man nicht nur problemlos verspeisen, sondern auch spritzen kann.
Solvent-Detergent-Verfahren: Eine sichere Sache
Auch Triton 100 ist für seine Sicherheit in Sachen medizinische Anwendungen bekannt. Das „Solvent-Detergent-Verfahren“ (SD-Verfahren), mit welchem die Grippeviren bei der Impfstoffherstellung zerlegt werden, wurde nämlich ursprünglich zur Reinigung von Blutplasma zur Transfusion von darin unerwünschten Viren entwickelt (Und wer hats erfunden…? Nein, ein Amerikaner. Aber die Schweizer – genauer gesagt eine Firma aus dem von hier aus übernächsten Dorf – haben es finanziert und zur Marktreife gebracht).
Die Blutplasma-Reiniger hatten ein ähnliches Problem wie die Impfstoff-Hersteller: Mögliche Viren in gespendetem Blutplasma müssen unschädlich gemacht werden (damit sie den Empfänger nicht infizieren können), aber die Proteine im Plasma – insbesondere die Gerinnungsfaktoren – dürfen dabei ihre Funktion nicht verlieren.
Das SD-Verfahren leistet beides äusserst gründlich: Die Gerinnungs-Proteine in SD-Plasma bleiben zu wesentlichen Teilen funktionsfähig, während nach rund 10 Millionen Transfusionen bis 2009 keine einzige Infektion durch Viren mit Hülle (bei „nackten“ Virenarten funktioniert das Verfahren nicht, sodass man sich um solche anders kümmert) gemeldet worden ist. Ebensowenig wurde je beobachtet, dass mit dem SD-Verfahren gereinigtes Plasma (wobei auch „Triton 100“ zum Einsatz kommt/kam!), in irgendeiner Weise toxisch gewirkt oder eine Allergie ausgelöst hätte.
Wasser zu Injektionszwecken
Lösungsmittel – und zwar das Lösungsmittel, wenn es um lebende Organismen geht. „Zu Injektionszwecken“ meint keimfrei und vermutlich so sauber wie irgend möglich. Schliesslich soll das ja in menschliche Körper gespritzt werden.
Gemäss meiner Annahme ausserdem der Grund dafür, dass die beiden oben genannten Emulgatoren noch in nennenswerter Menge im Impfstoff enthalten sind. Denn ohne sie würden sich die Virenproteine schlecht mit dem Wasser mischen. Und würde man auf ein fettfreundliches Lösungsmittel für den Impfstoff ausweichen, würde der sich mit der wasserfreundlichen Umgebung im Muskel gewiss nicht gut vertragen.
Weitere mögliche Inhaltsstoffe im Spurenbereich
Natürlich ist kein Reinigungsverfahren perfekt. So bleiben in jedem Produkt, das Reinigungsschritte durchläuft, winzige Spuren von Stoffen aus der Produktion zurück. So auch bei Impfstoffen. Die heutige Analytik ist allerdings derart präzise, dass damit festgestellte „Spuren“ wirklich extrem winzig und meist gar nicht von Bedeutung sind.
In Fluorix Tetra® können folgende Stoffe in solch winzigen Spuren gefunden werden:
Bestandteile von Eiern
Unter anderem Proteine: Die bleiben bei der Trennung der Viren (-Bestandteile) vom Material aus dem Ei übrig. Unglücklicherweise (in diesem Fall) ist unser (adaptives) Immunsystem noch präziser als die moderne Spurenanalytik. So können schon einzelne Proteinmoleküle, die das Immunsystem „in den falschen Hals bekommt“, heftige allergische Reaktionen auslösen.
Menschen, die allergisch auf Ei-Proteine reagieren, können daher nicht mit den üblichen Impfstoffen gegen Grippe geimpft werden und sind deshalb auf Herdenschutz angewiesen!
Gentamicinsulfat
Ein Antibiotikum. Die kommen bei der Virenzucht in Eiern nicht zu knapp zum Einsatz (auch das ist ein Grund dafür, bald einen Ersatz für diese Methode zu finden). Die winzigen Mengen, die mit einer Impfdosis in den Muskel wandern, werden dort aber sicher rasch verstoffwechselt, bevor sie irgendetwas bewirken können.
Formaldehyd
Auch: Methanal, CH2O. Ist als Chemikalie in Flaschen ein ziemlich fieser Geselle (ein giftiges, ätzendes, erbgutschädigendes und krebserzeugendes wasserlösliches Gas).
Formaldehyd entsteht allerdings auch als Stoffwechselabfall im menschlichen Körper (und anscheinend auch in Hühnereiern bzw. beim Zerlegen von Viren). Und das in rauhen Mengen von 50 Gramm (!) pro Erwachsenem am Tag! Da solche Mengen Gift uns natürlich nicht zuträglich wären, baut der Körper diesen Abfall aber ratzfatz ab: Die Halbwertszeit von Formaldehyd im menschlichen Körper liegt bei 90 Sekunden bzw. 1,5 Minuten. Nach dieser Zeit ist von ursprünglichem Formaldehyd also nur noch die Hälfte vorhanden.
Mit einer Impfdosis gelangen nun schätzungsweise 1 bis 200 Mikrogramm Formaldehyd in den Körper. Zum Vergleich: Ein Liter Blut enthält normalerweise 2 bis 3 Milligramm davon. Das ist die 10- bis 1000-fache Menge! Enthält eine Impfdosis tatsächlich solche Spuren von Formaldehyd, fallen die vor dem Hintergrund des natürlichen Formaldehyds im Körper gar nicht auf.
Natriumdesoxycholat
Noch ein Tensid, das beim Virenzerlegen zum Einsatz kommt. Und ein Salz der Desoxycholsäure, einer sekundären Gallensäure, die in der Leber und von bestimmten Darmbakterien für den Einsatz im Fettstoffwechsel hergestellt wird.
Das Anion in diesem Salz ist Steroid-Hormonen sehr ähnlich. Vermutlich wird es deshalb – anders als die oben genannten Emulgatoren – vor der Fertigstellung des Impfstoffs vollständig wieder entfernt. Aber falls doch mal ein paar Ionen zurückbleiben, werden auch die zwischen den natürlichen Steroiden nicht weiter auffallen.
Was in diesem Impfstoff nicht enthalten ist
Nicht auf der Liste und damit nicht im Impfstoff enthalten sind folgende berüchtigte Kandidaten:
- In irgendeiner Form krank machende Viren oder Virenbestandteile
- Quecksilberverbindungen wie Thiomersal
- Aluminiumverbindungen
- Sonstige Konservierungsmittel (ausser Vitamin E und dem Phosphat-Puffer)
In den heutigen Impfstoffen, die meist als Einzeldosen verpackt und gekühlt auf den Markt kommen, ist generell kein Thiomersal mehr enthalten – weil es gar nicht mehr notwendig ist.
In früherer Zeit kamen solche Konservierungsstoffe zum Einsatz, als Impfstoffe noch in handlichen Flaschen zum vielfachen Aufziehen in die Spritze durch ein Septum ausgeliefert wurden.
Solche Flaschen kommen heute allenfalls dann noch zum Einsatz, wenn eine Pandemie droht und die Verteilung des Impfstoffs schnell gehen muss.
Und was ist mit anderen Impfstoffen?
Einen kurzen Blick habe dann doch noch auf die Fachinformation zu einem MMRV-Impfstoff (Priorix Tetra, neueste Zulassung in Österreich 2010): Masern-Mumps-Röteln-Windpocken) geworfen. Der wird tatsächlich in Durchstechflaschen vertrieben, allerdings in Pulverform, mit einem Lösungmittel (Wasser), das direkt vor der Benutzung dazugespritzt wird.
Es handelt sich um einen Lebendimpfstoff, der aus „zahnlosen“ Viren besteht, die wiederum in Zellkulturen gezüchtet werden (Masern und Mumps in embryonalen Hühnerzellen, weshalb Probleme für Ei-Protein-Allergiker auch hier nicht ganz ausgeschlossen werden können).
Darüber hinaus ist in diesem Impfstoff sogar noch weniger drin als im Grippe-Impfstoff. Neben den vier Virenstämmen nämlich Lactose (Milchzucker), die Süssstoffe Sorbitol und Mannitol (irgendetwas braucht man wohl als Trägersubstanz für die Viren) und verschiedene natürliche Aminosäuren. Ausserdem können Spuren des Antibiotikums Neomycin (auch Zellkulturen kommen nicht ohne Antibiotika aus) enthalten sein.
Auch hier: Kein Thiomersal, keine Aluminiumverbindungen, keine anderen Konservierungsmittel (Pulver halten sich oft besser als Flüssigkeiten).
Fazit
Auch wenn ich mir willkürlich nur einen einzigen Grippe-Impfstoff (und einen MMRV-Impfstoff) herausgegriffen habe, zeigt die Auflistung doch deutlich, dass praktisch alle Schreckensgeschichten über „böse“ Bestandteile von Impfstoffen Mythen sind. Und die Stoffe, die tatsächlich darin sind, sind so verträglich, wie Stoffe nur sein können.
Einzig die Herstellung der Impfstoffe in den Hühnereiern ist ein Wehrmutstropfen – vegan oder vegetarisch sind (die meisten) Grippe-Impfstoffe damit sicherlich nicht. Auch als bekennende Allesesserin drücke ich fest die Daumen, dass wir bis in 5 Jahren Alternativen ohne tote (Vielzeller-)Tiere, Probleme für Allergiker und all zu viel Antibiotikaeinsatz haben werden.
Nichts desto trotz werde ich mich gegen die Grippe impfen lassen, sobald meine Erkältung überstanden ist. Nicht nur um meinetwillen, sondern auch aus Solidarität gegenüber meinen Schülern und ihren Familien (denn als Nachhilfelehrerin und eifrige ÖV-Nutzerin habe auch ich mit vielen Menschen zu tun).
Und was ist mit euch? Habt ihr euch gegen die Grippe impfen lassen? Oder werdet ihr noch?