Der Winter ist die Jahreszeit der grossen Temperaturunterschiede: Draussen frostig kalt, drinnen lauschig warm. Und dazwischen das ständige Wechseln zwischen dicker Vermummung und leichterer langärmeliger Wohnungskleidung. Langärmelig? Wo wir uns im Sommer bei der gleichen Raumtemperatur erst im T-Shirt richtig wohl fühlen?
Dieses Phänomen beschäftigt wohl auch meine treue Leserin Claudia, die diese interessanten Fragen gestellt hat:
Warum empfinden wir Temperaturen so unterschiedlich? Warum können minus 3 Grad genauso kalt wirken wie minus 15 Grad? Und umgekehrt: Warum schwitzen und stöhnen wir bei 28 Grad im Sommer, aber im Winter finden wir dieselbe Temperatur kuschelig warm?
Wie wir Temperaturen fühlen können
Damit wir die Temperatur unserer Umgebung ertasten können, ist die menschliche Haut von feinen Nervenenden durchzogen, die als Temperatursensoren arbeiten. Davon haben wir Menschen zweierlei: Wärmesensoren für den Eindruck „warm“ und Kältesensoren für den Eindruck „kalt“.
Diese Wärme- und Kältesensoren messen allerdings nicht direkt die Temperatur der Luft oder was uns sonst umgibt. Stattdessen messen sie die Temperatur des sie umgebenden Gewebes! Und die Gewebetemperatur hängt von vielen äusseren Faktoren ab:
- Wärmeproduktion im Körper: Je mehr wir in Bewegung sind, desto mehr Wärme fällt aus den Muskeln ab und erwärmt das Hautgewebe.
- Umgebungstemperatur: Liegt die Temperatur ausserhalb des Körpers deutlich unter der Körpertemperatur von 37°C (das ist die Regel), wird die im Körper produzierte Wärme leicht an die Umgebung abgegeben: Das Hautgewebe kühlt ab. Je wärmer die Umgebung ist, desto schwieriger ist die Wärmeabgabe über die Haut: Das Gewebe bleibt warm.
- Schweissproduktion: Unser grosser Vorteil gegenüber den meisten anderen Säugetieren: In der menschlichen Haut gibt es Schweissdrüsen, aus welchen Flüssigkeit auf die Hautoberfläche gelangen kann. Wenn diese verdunstet, wird dafür Wärme aufgewendet (diese „Verdampfungswärme“ ist analog zur „Schmelzwärme“, welche ihr mit diesem Versuch erforschen könnt): Das Gewebe unter der feuchten Hautoberfläche kühlt ab, während der aufsteigende Wasserdampf die Wärme mit sich nimmt. So läuft der menschliche Körper auch bei Lufttemperaturen nahe oder über der Körpertemperatur nicht heiss. Der Nachteil: Um die ausgeschwitzte Flüssigkeit zu ersetzen, müssen wir sie trinken. Nässe von aussen (z.B. durch Regen oder nach einem Bad) hat übrigens den gleichen Effekt.
- Wind: Ein Luftstrom transportiert Körperwärme schneller von der Hautoberfläche ab als stehende Luft. So trägt Wind dazu bei, dass wir unsere Umgebung als kühler empfinden – ganz besonders, wenn unsere Haut feucht ist, sodass der Wind zusätzlich die Verdunstung der Feuchtigkeit fördern kann. – Luftfeuchtigkeit: Wasser kann nur dann zügig verdunsten, wenn noch nicht zu viel Wasserdampf in der die feuchte Haut umgebenden Luft ist. Bei hoher Luftfeuchtigkeit ist kurz gesagt kaum noch Platz in der Luft für weiteren Wasserdampf. Unser Schweiss bleibt also flüssig und der Kühlungseffekt durch das Schwitzen bleibt aus. Der Körper schwitzt daraufhin nur noch mehr, ohne jedoch nennenswert abzukühlen. Deshalb empfinden wir tropisches Klima schon bei mässig warmen Temperaturen als furchtbar heiss, während wir selbst mit Temperaturen oberhalb der Körpertemperatur in einer trockenen Wüste leichter fertig werden (wenn wir genug zu trinken haben!).
- Kleidung: „Warmblütige“ Tiere haben (in der Regel) ein Fell oder Gefieder, das eine wärmende (oder kühlende) Luftschicht über der Haut einschliessen und festhalten kann. Da wir Menschen weitgehend nackt sind, ersetzen wir das fehlende Fell mit Kleidung. Die hält den Wind und bestenfalls Nässe von der Haut fern und umschliesst stattdessen eine stehende Luftschicht, die geordnet Wärme aus dem Körperinneren aufnehmen und langsam an die Umgebung abgeben kann. Wehe aber, diese Kleidung saugt sich mit Wasser voll: Wenn das verdunstet, wird nämlich reichlich Wärme aus dem Körper abgeführt. Und dem Menschen in nasser Kleidung wird furchtbar kalt. Nützlich ist das nur bei hoher Umgebungstemperatur: Dann erspart uns trocknende Kleidung am Leib nämlich zumindest zeitweilig das Schwitzen.
Feuchtigkeit und Wind sind die beiden wichtigsten Faktoren, die gemeinsam bewirken, dass unsere Haut bei feuchtwindigen -3°C mitunter genauso schnell abkühlt wie bei trockenen -15°C, und wir beide Temperaturen mitunter als gleich empfinden. Diese Unzulänglichkeit unseres Temperaturempfindens stört auch gar nicht weiter. Denn zum (Über-)Leben ist die eine wie die andere Temperatur zu niedrig. Da reicht die Information „Kalt!!!“ völlig aus, um schleunigst ein geschütztes, warmes Plätzchen zu suchen.
Dazu kommen körperliche Unterschiede von Person zu Person
- Die Wärme- und Kälterezeptoren sind genetisch bedingt von Mensch zu Mensch verschieden zahlreich vorhanden und unterschiedlich auf die Körperoberfläche verteilt.
- Männer haben meist mehr Körpermasse unter einer relativ kleinen Körperoberfläche, während Frauen eine im Verhältnis zu ihrer Masse grössere Körperoberfläche haben. Und weniger Körperoberfläche bedeutet weniger Gelegenheiten für die Körperwärme, den Körper zu verlassen. So verlieren Männer in der Regel weniger Körperwärme als Frauen in gleicher Umgebung. Mein Partner Reto ist da allerdings eine Ausnahme: Der ist sehr hager und hat merklich schneller kalt als ich.
Und warum empfinden wir die gleiche Temperatur von 28°C im Winter als warm und im Sommer als kühl?
Dieser Umstand wird auf die Funktionsweise der Wärme- und Kältesensoren in unserer Haut zurückgehen. Die funktionieren nämlich zum Einen nur in jeweils einem eng gesteckten Temperaturbereich, und registrieren zum Anderen vor allem Temperaturänderungen
Wie unsere Kalt- und Warmsensoren Temperaturänderungen messen
Dazu senden die Sensoren permanent eine regelmässige Folge elektrischer „Pings“ an das Gehirn, ähnlich dem Sonar eines U-Bootes. Ein gleichförmiges Signal interessiert uns aber wenig, sodass es in der Regel vor dem Eingang ins Bewusstsein ausgefiltert wird. Erst wenn sich die Temperatur des Hautgewebes ändert, steigt die Frequenz der Pings stark und das Bewusstsein wird darauf aufmerksam. Sobald die Temperatur bei einem neuen Wert gleich bleibt, pendelt sich auch die Ping-Frequenz bei einem mässigen, vom Anfang leicht unterschiedlichen Wert ein – und gerät bald wieder in Vergessenheit. Bis zur nächsten Temperaturänderung.
Zwei abgedeckte Temperaturbereiche und ihre Grenzen
Dazu kommt, dass unsere zwei Sorten Temperatursensoren in verschiedenen Bereichen arbeiten:
- Die Kaltsensoren von 15°C bis 30°C (Wird unsere Haut kälter, fühlt sie sich entsprechend „taub“ an)
- Die Warmsensoren von 30°C bis 45°C (würde unsere Haut wärmer, verlören die Proteine darin ganz schnell ihre Funktionsfähigkeit: Wir würden gedünstet!).
Dazu kommen Schmerzrezeptoren, die uns davor bewahren, diese Grenzen des mit Leben verträglichen Temperaturbereichs nicht fahrlässig zu überschreiten. Wenn ihr einmal eine heisse Quelle findet, die in ein (an sich kühles) Gewässer mündet, könnt ihr das selbst ausprobieren:
Habt ein (am besten elektronisches) Thermometer bei euch. Betretet barfuss das Gewässer an einer angenehm temperierten Stelle und nähert euch langsam der heissen Quelle. Sobald ihr es nicht mehr im Wasser aushaltet (weil es wehtut!), geht einen Schritt zurück – eben da hin, wo es euch nicht mehr weh tut – und messt die Temperatur.
Ich habe dieses Experiment während unsrer Australienreise machen können: Meine Schmerzgrenze liegt ziemlich genau bei 43°C (also noch innerhalb des Bereichs, den die Warmsensoren abdecken). Das macht Sinn, denn die „offizielle“ Höchsttemperatur, ab welcher unsere Proteine ihre Funktionsfähigkeit verlieren, beträgt 42°C.
Doch auch plötzliche Kälte kann Schmerzreize auslösen. Das ist auch sinnvoll, denn extreme Kälte kann unser Körpergewebe genauso zerstören wie extreme Wärme!
Beispiele für die Arbeit der Warm- und Kalt-Sensoren
Wenn wir im Winter von draussen reinkommen, nimmt der Wärmeverlust über die Haut rasch ab, da die Luft aussen um uns herum schnell einmal 20°C wärmer wird. Die Haut wärmt sich rasch auf und die Kältesensoren melden: Sehr viel weniger kalt! Und sobald die Gewebetemperatur die 30°C überschreitet, beginnen die Wärmesensoren zudem „Warm!“ zu melden.
Wenn wir dagegen im heissen Sommer nach draussen gehen, wird die Wärmeabgabe über die Haut plötzlich schwierig, sodass die Temperatur des Gewebes leicht bei über 30°C ansteigt. Die Wärmesensoren, die zuvor inaktiv waren, melden nun: Warm!. Wenn wir aber wieder in die auf 20°C klimatisierte Wohnung gehen, sinkt die Gewebetemperatur: Die Wärmesensoren melden „weniger warm“. Unterschreitet die Gewebetemperatur dabei die 30°C, beginnen die Kältesensoren zudem, „Kalt!“ zu melden.
Aus der Kälte kommend empfinden die Kältesensoren 28°C (im Gewebe!) also als „Wärmer!“ (= „weniger kalt“), ehe die Wärmesensoren mit einer ersten „Warm!“-Meldung zu arbeiten beginnen.
Indessen beginnen aus der Wärme kommend die Kaltsensoren erst bei knapp unter 30°C mit einer ersten „Kalt!“-Meldung zu arbeiten, nachdem die Wärmesensoren zunächst „weniger warm“ gemeldet haben.
Die Fähigkeit unserer Temperatursensoren, Temperaturänderungen zu messen, erlaubt uns also, die Richtung einer Temperaturänderung (nach oben oder nach unten) zu erkennen, auch wenn uns das Gefühl für die absolute Temperatur damit abgeht.
Kalt haben oder frieren? Wo ist der Unterschied?
Wenn wir Kälte empfinden bzw. „kalt haben“, wie wir hier in der Schweiz sagen, frieren wir nicht automatisch. Das geschieht nämlich erst, wenn die Innentemperatur unseres Körpers unter den Sollwert fällt.
Dazu kommt es entweder, wenn wir zu viel Wärme an die Umgebung verlieren und so eine (beginnende) Unterkühlung erleiden, oder wenn wir Fieber bekommen. Dann nämlich setzt die Körper-Kontrollzentrale den Sollwert für die Temperatur im Körperinneren um wenige Grad Celsius nach oben (die höhere Temperatur bedeutet mehr Energie für Stoffwechselvorgänge zur Infektabwehr und eine unbequemere Umgebung für Krankheitserreger – kurzum: Kriegszustand).
Beim Vergleich des neuen Solls mit dem Ist-Zustand stellen die Gewebe so dasselbe fest wie bei einer Unterkühlung: „Wir sind zu kalt – wir müssen mehr Wärme produzieren und festhalten!“
Viel Wärme können vor allem die Muskeln produzieren, wenn sie sich bewegen. Also fangen die Muskeln wild an zu zucken und zu zittern: Schüttelfrost! Dazu kommt ein generelles Kälteempfinden, das uns unter möglichst warme Decken kriechen lässt – dort geht dem Körper weniger Wärme verloren.
Auch eine „Gänsehaut“ dient(e) übrigens dazu, Wärme im Körper festzuhalten: Sie ist der Versuch, unser (fast) nicht mehr vorhandenes Fell zu sträuben, sodass es eine lauschig warme Luftschicht über der Haut umschliessen kann.
Zusammenfassung
Wir Menschen (und viele andere Tiere) nehmen vornehmlich Änderungen der Temperatur unseres Hautgewebes wahr. Diese Temperatur kann von einer Vielzahl von Faktoren beeinflusst werden.
Zur Temperaturwahrnehmung kommen zwei Sorten Sensoren für verschiedene Temperaturbereiche zum Einsatz. So kann die Überschreitung der Grenze zwischen den beiden Bereichen je nach Richtung zu unterschiedlichen Signalfolgen führen.
Zusätzliche Schmerzrezeptoren hindern uns daran, den wahrnehmbaren lebensfreundlichen Temperaturbereich leichtfertig zu verlassen.
Kalt haben bedeutet aber nicht automatisch frieren: Wir frieren erst (mit Schüttelfrost und starkem Verlangen nach wärmerer Umgebung), wenn die Körperinnentemperatur unter den Sollwert fällt.
Sind euch diese Eigenheiten unserer Temperaturwahrnehmung auch schon aufgefallen? Bei welchen Umgebungsbedingungen fühlt ihr euch denn am wohlsten?




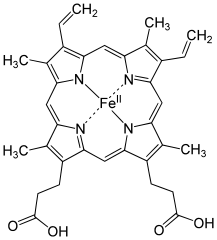 Das in der Abbildung gezeigte Häm b ist dunkelrot. Innerhalb des Kohlenstoff-Rings wechseln sich Einzel- und Doppelbindungen ab. Das bedeutet, dass ein Teil der an den Bindungen beteiligten Elektronen sich relativ frei bewegen und dazu einfallende Lichtquanten „schlucken“ können, sodass das menschliche Auge das verbleibende Licht als farbig wahrnimmt. (
Das in der Abbildung gezeigte Häm b ist dunkelrot. Innerhalb des Kohlenstoff-Rings wechseln sich Einzel- und Doppelbindungen ab. Das bedeutet, dass ein Teil der an den Bindungen beteiligten Elektronen sich relativ frei bewegen und dazu einfallende Lichtquanten „schlucken“ können, sodass das menschliche Auge das verbleibende Licht als farbig wahrnimmt. (







