Eine Leserin hat einen Kalkfänger gekauft: Einen Ring aus Edelstahl-Wolle, welchen man in einen Wasserkocher oder eine Kaffeemaschine legen kann. Dort soll er den Kalk daran hindern, sich an Wänden und Boden des Wasserbehälters abzusetzen. Doch wie funktioniert so ein Kalkfänger? Wie verwendet man ihn richtig? Und birgt so ein Ring Gesundheitsgefahren?
Wie funktioniert ein Kalkfänger?
Wenn du den Kalkfänger verstehen möchtest, musst du zunächst wissen, was er eigentlich fangen soll.
Was ist Kalk?
Kalk, eigentlich Calciumcarbonat, ist eine Verbindung aus zweierlei Ionen, nämlich Calcium- (Ca2+) und Carbonat (CO32-) – Ionen, die sich zu einem festen Kristallgitter zusammenlagern können. Solch eine Ionenverbindung wird kurz und bündig auch „ein Salz“ genannt.
Wie der Name vermuten lässt, gehört auch das jedem bekannte Kochsalz zu den ionenverbindungen. Sowohl die Ionen des Kochsalzes (Na+ und Cl–) als auch die Ionen des Kalks können sich in Wasser lösen. Das heisst, ein jedes Ion kann sich frei zwischen den Wassermolekülen bewegen. Anders als die Paarung von Na+ und Cl– im Kochsalz sind Ca2+ und Hydrogencarbonat (HCO3–), das beim Auflösen aus CO32- entsteht, in Wasser nur wenig darauf erpicht, voneinander zu lassen: Kalk ist sehr viel weniger gut wasserlöslich als Kochsalz.
Das bedeutet, dass schon wenige anfangs gelöste Calcium- und Carbonat-Ionen sich schnell zu einem festen Ionenkristall zusammenlagern, sobald die äusseren Bedingungen sie dazu „auffordern“. Und eine dieser Aufforderungen besteht in der Zunahme der Wassertemperatur – also beim Erhitzen des Wassers im Kochgerät.
Wenn du dich ein wenig mit Chemie auskennst, weisst du vielleicht, dass eine höhere Temperatur des Lösungsmittels normalerweise dazu führt, dass sich Salze besser darin lösen. Die Fällungs.Reaktion, die zur Kalk-Entstehung führt, ist allerdings eine ganz besondere:
Aus den in Wasser (aq) gelösten Ionen entsteht neben festem (s) Kalk (CaCO3) und Wasser das Gas (g) Kohlenstoffdioxid (CO2)! Kohlenstoffdioxid löst sich wiederum in Wasser oder verflüchtigt sich in die Umgebungsluft – beides um so besser, je höher die Temperatur des Ganzen ist. Der in der Gleichung deutet an, dass sich alle genannten Beteiligten miteinander in einem dynamischen Gleichgewicht befinden. Le Châtelier erklärt das auf dem Flughafen genauer. Hier sei nur dass nach ihm benannte Gesetz benannt, welches besagt, dass solche Gleichgewichte einem auf sie ausgeübten Zwang stets ausweichen. Entfernt man also CO2 auf der „rechten“ Seite – zum Beispiel. durch Lösen oder Verdampfen – reagieren mehr Ionen zu CO2, um dieses zu ersetzen. Dabei entstehen dann zwangsläufig auch Wasser und fester Kalk.
In unserem Leitungswasser sind nun immer mehr oder weniger Calcium- und Carbonat-Ionen enthalten. Und sobald wir das Wasser in einem Schnellkocher oder einer Kaffeemaschine zum Kochen oder nahe daran bringen, verschiebt sich das „Kalk-Kohlensäure-Gleichgewicht“ darin nach „rechts“, auf die Seite mit dem festen Kalk., In Folge dessen ordnen sich die Ionen auf den an die Lösung grenzenden festen Oberflächen (Wand und Boden des Kochgefässes) zu festen, als „Kalk“ bekannten Strukturen an.
Wie alles, was in Eile entsteht, haben solche Kalkschichten auf den ersten Blick wenig mit symmetrischen weil sorgfältig aufgebauten Kristallen gemein. Stattdessen sind sie rauh, weisslich, formlos und oft porös, sodass sie vielerlei Kleinstlebewesen wie Bakterien oder Pilzen Lebensraum bieten können. So macht Kalk sich in der Küche gleich mehrfach unbeliebt.
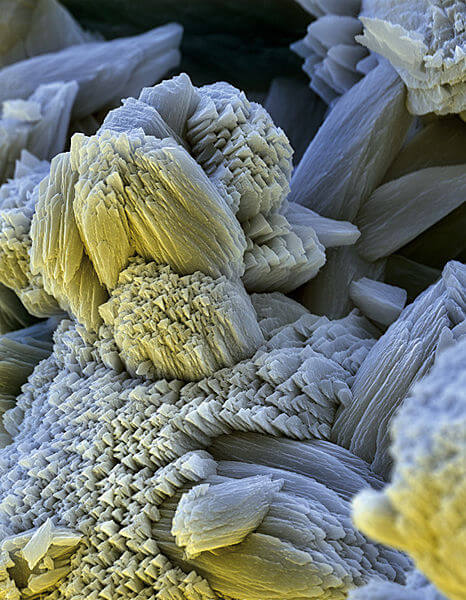
Erst unter dem Elektronenmikroskop wird erstichtlich, dass Kalk – auch bekannt als „Kesselstein“ – aus symmetrischen Kristallen besteht. Stefandiller at the German language Wikipedia [CC-BY-SA-3.0], via Wikimedia Commons
Wie kalkhaltig ist mein Wasser?
Kalkhaltiges Wasser wird landläufig auch als „hartes“ Wasser bezeichnet – vermutlich, weil daraus feste, also harte Ablagerungen hervorgehen können. Die Wasserhärte wird je nach Land in verschiedenen „Härtegraden“ angegeben. Der einfachen Messbarkeit halber steht ein Härtegrad für die Menge an gelösten Metallionen ( Ca2+ und – für alle, die es genau nehmen – auch das chemisch eng verwandte Magnesium-Ion Mg2+) in einem bestimmten Wasser-Volumen – also für die Konzentration derselben.
In Deutschland und Österreich wurde früher der deutsche Härtegrad °dH verwendet, wobei 1°dH einer Konzentration von rund 0,18 Millimol Ionen pro Liter Wasser (über die Stoffmengeneinheit mol kannst du hier mehr erfahren!) entspricht. In der Schweiz verwendet man bis heute den französischen Härtegrad °fH, der wesentlich weniger krumm definiert ist: 1°fH entspricht 0,1 Millimol Ionen pro Liter Wasser (das entspricht übrigens einem Metall-Ion auf 10000 Wasser-Moleküle).
Wie hart das Leitungswasser in deiner Region ist, kannst du im Netz nachschlagen. Hier gibt es Übersichtskarten für die Schweiz, für Deutschland und für Österreich. In meiner Heimatgemeinde am oberen Zürichsee ist das Wasser demnach mittelmässig hart.
Wie kann Stahlwolle das Verkalken verhindern?
Damit Kalk sich ablagern kann, braucht es stets eines: Eine Oberfläche, auf der die ersten Ionen Platz finden. Normalerweise haben sie da im Wasserkocher keine grosse Wahl – ihnen bleibt nur die meist glatte Fläche von Boden und Wänden des Gefässes.
Stahlwolle besteht jedoch aus einer Vielzahl feiner, auf engem Raum miteinander verworrener Bänder oder Drähte, die zusammengenomme eine vielfach grössere Oberfläche als der Wasserbehälter haben. Wenn Kalk sich absetzt, suchen sich die Ionen im Wasser in zufälliger Reihenfolge die nächstbeste Oberfläche, um sich dort anzuordnen. Und wenn nun 9 von 10 Teilen der gesamten verfügbaren Oberfläche zum herausnehmbaren Stahlring gehören, werden sich so 9 von 10 absetzwilligen Ionen darauf niederlassen, während nur eines auf der Gefässwand landet.
Demnach verkalken die Gefässwände, wenn ein solcher gedachter Kalkfänger zum Einsatz kommt, im Idealfall 10 mal langsamer als ohne.
Wie wende ich den Kalkfänger richtig an?
Die Erklärung macht deutlich: Ein Kalkfänger kann die Ablagerung von Kalk im Wasserkocher niemals verhindern, sondern nur verlangsamen. Noch weniger kann er bereits vorhandene Kalkrückstände entfernen!
Um die beste Leistung aus deinem Kalkfänger aus Stahlwolle herauszuholen, beachte daher folgendes:
- Verwende den Kalkfänger nur in einem kalkfreien, also frisch entkalkten oder neuen Kochgefäss.
- Entkalke das Kochgefäss künftig merklich seltener als zuvor 🙂 .
- Wenn Kalkablagerungen auf bzw. in dem Stahlring sichtbar werden, wasche ihn aus oder lege ihn eine Weile in Kalklöser ein.
- Je härter dein Leitungswasser ist, desto grösser wird der Bruchteil der Ionen sein, die trotz Stahlwolle den Weg auf die Gefässwände finden (wie auch der Anteil auf der Stahlwolle grösser ist, sodass der Ring ggfs. öfter gereinigt werden muss).
Wie kann ich mein Gefäss und den Kalkfänger entkalken?
Die Ionenverbindung Calciumcarbonat leitet sich von der Kohlensäure ab – einer sehr schwachen Säure. Eine Gesetzmässigkeit der Chemie besagt, dass stärkere Säuren die einer schwächeren Säure verwandten Salze auflösen können. In Folge dessen kann man Kalkablagerungen mit praktisch jeder gängigen Säure ein Ende machen.
Fülle einfach das zu entkalkende Gefäss mit Wasser und gib gemäss der Dosierungsanleitung auf der Packung Essig bzw. Zitronensäure dazu (je mehr Kalk zu beseitigen ist, desto mehr Säure wirst du brauchen) und warte ein paar Stunden.
Ich bevorzuge zu diesem Zweck Essigsäure (z.B. Essigessenz, Haushaltsessig) oder Zitronensäure in Wasser. Diese beiden organischen Säuren bzw. ihre Verbindungen sind nicht nur Bestandteil vieler Lebensmittel, sondern auch unseres Körpers. So ist es völlig unbedenklich, sollten wir ein wenig davon aufnehmen. Im Gegenteil: In Zitrusfrüchten bzw. Salatsauce schätzen wir sie schliesslich sehr.
Essigsäure kannst du auch aufkochen (Zitronensäure kann dabei das ebenfalls schwerlösliche Salz Calciumcitrat bilden, die also nicht zu stark erhitzen!) – die aufsteigenden Dampfblasen helfen dabei, die Kalkablagerungen von der Gefässoberfläche abzulösen – dann geht die Reinigung schneller.
Achte nur darauf, dass keine Säurespritzer in deine Augen kommen – auch Essig und Zitronensäure wirken ätzend!
Der Nachteil dieser beiden Säuren ist ihr deutlicher Eigengeruch und -geschmack. Wenn du also kein Zitronen- bzw. Essig-Aroma in deinem Tee oder Kaffee wünschst, spüle dein Kochgerät bzw. den Kalkfänger nach dem Entkalken sehr gründlich aus.
Birgt ein Kalkfänger Gesundheitsgefahren?
Kurz gesagt: Nein. Kalkfänger bestehen aus rostfreiem Edelstahl, also aus einer Legierung hauptsächlich aus metallischem Eisen und Chrom, und Spuren weiterer Elemente wie Mangan, Silizium und Kohlenstoff. Kochgeschirr, Essbesteck, Küchenoberflächen und viele andere Geräte bestehen aus demselben Material, weil es einige sehr nützliche Eigenschaften in sich vereint:
- Stahl ist für ein Metall bzw. ein Gemisch aus Metallen vergleichsweise hart, sodass er auch bei Beanspruchung weitgehend glatt und daraus gefertigte Klingen oder Kanten scharf bleiben.
- Die Hauptbestandteile, Eisen und Chrom, und die Stahlherstellung sind vergleichsweise preisgünstig (ein Kalkfänger aus Goldwolle würde wohl auch funktionieren – den würde nur kaum jemand bezahlen wollen).
- Wie der Name sagt, rostet „rostfreier“ Stahl unter normalen Umständen – und die schliessen Kochvorgänge mit Wasser ein – nicht. Das heisst, er wird von Sauerstoff und Wasser nicht angegriffen und oxidiert (mehr zu Rost und Korrosion erfährst du hier).
Die Beständigkeit gegenüber Korrosion bringt überdies mit sich, dass Edelstahl in der Küche – also auch Kalkfänger aus Edelstahl-Wolle – gesundheitlich unbedenklich sind. Schliesslich sind sie dazu geschaffen, sich nicht aufzulösen. Und sollte sich dennoch im Zuge eifrigen Kochens das ein oder andere Atom aus der Metalloberfläche lösen, gelten für diese Abtrünnigen zwei Dinge:
- Ungeladene Eisen- und Chromatome, wie sie in einer Metalloberfläche vorkommen, haben für Reaktionen in Lebewesen praktisch keine Bedeutung. Erst, wenn sie oxidiert und damit zu Ionen werden, stellt sich die Frage nach ihrem Nutzen oder ihrer Giftigkeit.
- Eisen-Ionen erfüllen im Körper lebenswichtige Aufgaben (zum Beispiel als Bestandteil des roten Blutfarbstoffs) und sind daher ein wichtiger Bestandteil unserer Nahrung. Auch Chrom-Ionen (Cr3+) sind Bestandteil unseres Körpers – ob sie dort einen besonderen Nutzen haben, ist hingegen umstritten. Damit sind weder Eisen- noch Cr3+-Ionen dem menschlichen Körper fremd. Selbst wenn sich also ein paar Metall-Atome aus einem Kalkfänger davonmachen und oxidiert werden (Magensäure kann das beispielsweise!), schaden sie der Gesundheit nicht.
Wie sinnvoll ist der Einsatz eines Kalkfängers tatsächlich?
Ich habe noch nie einen Kalkfänger verwendet. Das Beitrag zeigt daher ein Stahlwolle-Knäuel, das zum Reinigen von Töpfen verkauft wird – aber genauso gut als Kalkfänger funktionieren sollte.
In den Kundenbewertungen verschiedener Anbieter im Netz scheiden sich jedoch über dem Nutzen oder Nicht-Nutzen der Stahlwolle die Geister. Ein guter Teil der schlechten Erfahrungen geht wahrscheinlich auf falsche Erwartungen bzw. Anwendungsfehler zurück. Letztendlich gebe ich diese Frage aber an euch zurück:
Habt ihr schonmal einen Edelstahl-Kalkfänger eingesetzt? Hat er in euren Augen funktioniert? Wie weit könnt ihr damit das Entkalken eures Kochgeräts hinausschieben? Teilt eure Erfahrungen in den Kommentaren mit uns!










