Was sind Zinkbäume? Pflanzen, die ganz aus Metall sind? Und wie können sie wachsen?
Mit Hilfe von elektrischem Strom! Wenn ihr eine Sicherheitsnadel verkupfert, könnt ihr beobachten, wie Metallatome in Form von Ionen durch Flüssigkeit von einem Metallstück zun nächsten wandern. Indem ihr statt einer Flüssigkeit festes Gemüse verwendet, könnt ihr diesen Umstand nutzen, um eine Kartoffelbatterie zu bauen. Aber wenn ihr schon eine gute Batterie oder ein Netzteil habt, könnt ihr das auch verwenden, um den Ionen vorzuschreiben, in welche Richtung sie wandern sollen. Zum Beispiel, um faszinierende Metallbäumchen wachsen zu lassen!
Ich habe dieses Experiment schon vor Jahren zu Hause gemacht, es aber bislang nicht verbloggt, weil die dabei verwendeten Stoffe nicht ganz ungefährlich sind. Unter anderem kann dabei Chlorgas entstehen. Lest deshalb die Beschreibung sehr gut durch – denn Sicherheitsmassnahmen und besonderer Aufwand bei der Entsorgung sind nötig! Wenn ihr alle Hinweise beherzigt, könnt ihr aber auch mit dem Chlor sicher umgehen.
Ihr braucht dazu
- Zwei grosse Stahlnägel
- Einen Weinkorken
- Klebefilm
- Einen kleinen, flachen Behälter (z.B. Tupperdose für Streichwurst)
- Gleichstromquelle: Eisenbahntrafo, Netzteil, 9V-Batterie oder Batterieblock (Spannung sollte mindestens 3V betragen!)
- Kabel oder Litze zum Verdrahten
- Krokodilklemmen oder Löt-Ausrüstung
- Zinkchlorid (ZnCl2)
 oder Zinkiodid (ZnI2)
oder Zinkiodid (ZnI2)
- Destilliertes bzw. destillatgleiches Wasser (letzteres gibt es im Supermarkt)
- Ggfs. Werkzeug und robuste Arbeitsplatte, um die Nägel zu knicken
- Natriumthiosulfat (oder ähnliches Reduktionsmittel) für die Entsorgung

Zinkchlorid oder Zinkiodid?
Bei der Elektrolyse von Zinkchlorid entsteht gasförmiges Chlor (Cl2), das aggressiv reagiert (es ist ein starkes Oxidationsmittel) und giftig ist. Sorgt deshalb beim Experimentieren für eine gute Belüftung: Wenn ihr ein Labor habt, arbeitet im Abzug, sonst am besten im Freien! Chlor löst sich weniger gut in Wasser und hat eine blassgrünliche Farbe. So nimmt es euch nicht die Sicht auf den Nagel, an dem die Zinkbäume wachsen.
Bei der Elektrolyse von Zinkiodid entsteht Iod (I2), das ein Feststoff ist. So besteht praktisch keine Gefahr, dass ihr etwas davon einatmet. Dafür ist Iod in Wasser gelblich bis kräftig braun, sodass es im schlimmsten Fall die Sicht auf die Zinkbäume am Nagel nebenan nehmen kann.
Somit haben beide Stoffe ihre Vor- und Nachteile. Ich überlasse es euch zu entscheiden, welchen ihr verwendet. Ich selbst habe mich, obwohl ich zu Hause keinen Laborabzug habe, für Zinkchlorid entschieden und das Experiment auf dem Balkon aufgebaut. So hatte ich sicher freie Sicht für alle Aufnahmen.
Verwendet von beiden möglichen Chemikalien so wenig wie möglich, denn so entsteht einerseits möglichst wenig giftiges Chlor, andererseits müsst ihr umso weniger entsorgen, je weniger Chemikalien ihr einsetzt!
So geht’s
- Bearbeitet beide Nägel so, dass sie nach etwa einem Drittel ihrer Länge einen Knick von ca. 120° machen.
- Verbindet die abgeknickten Köpfe der Nägel mit Kabeln, die ihr später an eure Stromquelle anschliessen könnt. Entfernt dazu die Isolierhülle der Litze und lötet je ein Kabelende an einem Nagel fest oder, wenn ihr Experimentierkabel mit Krokodilklemmen verwendet, klemmt jedes davon an Kopf eines Nagels.
- Schneidet den Weinkorken längst in zwei Hälften. Klebt die Nägel so auf die Wölbung einer Korkenhälfte, dass sie sich nicht berühren! Die abgeknickten Köpfe mit den Lötverbindungen bzw. Klemmen sollen dabei nach oben ragen. Legt die Korkenhälfte mitsamt der Nägel in den kleinen Behälter und klebt ihn mit dem Klebefilm am Boden fest (der Korken soll nicht wegschwimmen!).
- Löst rund 13,5g Zinkchlorid oder 31,9g Zinkiodid in 100 Milliliter destilliertem Wasser auf. So erhaltet ihr eine Lösung mit einer Konzentration von rund 1 mol/l (Mehr zu Stöchiometrie hier).
- Gebt eben so viel von dieser Lösung in den Behälter mit den Nägeln, dass die flach liegenden Teile der Nägel vollständig bedeckt sind. Die abgeknickten Enden mit den Kontakten sollen jedoch ausserhalb der Lösung und trocken bleiben!
- Verbindet einen Nagel mit dem Plus-, den anderen mit dem Minuspol eurer Stromquelle.
- Wenn alles bereit ist, schaltet den Strom ein und dreht ihn ggfs. (wenn ihr einen Trafo mit Drehschalter benutzt) langsam auf.
- Schaltet den Strom unbedingt wieder ab, wenn eure Zinkbäume gross genug sind!
Zinkbäume: Das könnt ihr beobachten
Wenn eine ausreichend hohe Spannung anliegt, bildet sich auf dem Nagel am Pluspol ein mattgrauer Überzug, aus dem bald feine metallische Verästelungen in Richtung des anderen Nagels herauswachsen: Auf dem Nagel wachsen kleine Zinkbäume!

Wenn ihr eine Zinkchlorid-Lösung verwendet, bilden sich am anderen Nagel kleine Gasblasen und ihr könnt bald einen stechenden Geruch wahrnehmen. Möglicherweise könnt ihr auch erkennen, dass das Gas eine grünliche Farbe hat.
Achtung! Atmet das Gas nicht ein! Es handelt sich um giftiges Chlor (Cl2)! Deshalb sollt ihr dieses Experiment unbedingt im Freien oder in einem Labor im laufenden Abzug („Kapelle“) machen. Lasst das Experiment nicht unnötig lange und nicht unbeaufsichtigt laufen, ganz besonders, wenn ihr im Freien experimentiert!
Wenn ihr eine Zinkiodid-Lösung verwendet, entsteht kein Gas. Dafür färbt sich die Flüssigkeit um den zweiten Nagel mit der Zeit bräunlich. Das elementare Iod (I2) ist bei Raumtemperatur nämlich ein Feststoff, der sich in einer Lösung mit Iodid-Ionen lösen kann oder sich in kleinen, festen Partikeln absetzt. Auch Iod ist gesundheitsschädlich, lässt sich aber wesentlich leichter im Zaum halten als das gasförmige Chlor.
Was passiert da?
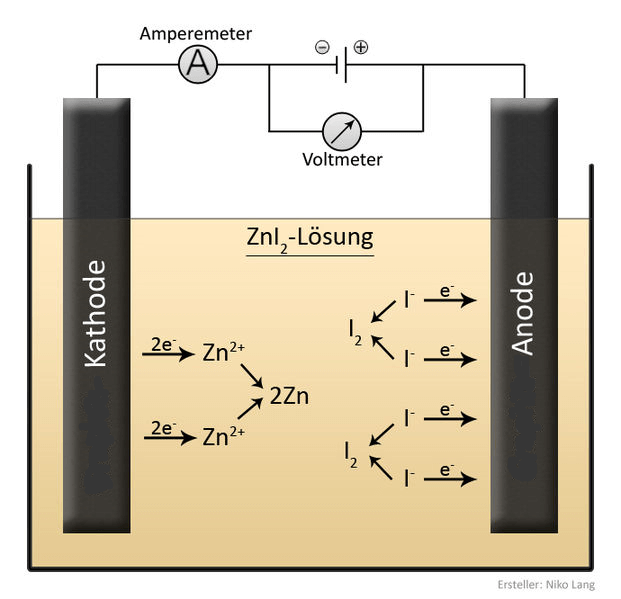
Eine Batterie oder andere Gleichstromquelle hat zwei Pole mit unterschiedlich grossen Elektronenvorräten. Am Minuspol gibt einen grossen Überschuss an negativ geladenen Elektronen, während am Pluspol gemessen an den sonstigen Atombestandteilen sehr wenig Elektronen vorhanden sind. Verbindet man den Minuspol der Batterie über eine elektrisch leitendes Kabel mit dem Pluspol, fliessen die überschüssigen Elektronen vom Minuspol schnell zum Pluspol, bis an beiden Polen gleich viele Elektronen sind. Elektronen, die durch ein leitendes Material fliessen, sind somit „Stromteilchen“.
Aber auch andere geladene, bewegliche Teilchen können zu Stromteilchen werden. So zum Beispiel Ionen in einer Lösung. Die beiden Nägel in diesem Versuch sind nichts anderes als Verlängerungen der beiden Pole eurer Stromquelle. Sobald die Quelle eingeschaltet ist, drängen die Elektronen vom Minuspol in den daran angeschlossenen Nagel, während Elektronen aus dem anderen Nagel zum Pluspol hin abfliessen. So ist der Minuspol-Nagel nun seinerseits negativ und sein Gegenüber positiv geladen.
Wie Zinkbäumchen wachsen können
Als ihr das Zinkchlorid (bzw. -iodid) im Wasser aufgelöst habt, sind die festen Kristalle zu einzelnen Ionen zerfallen:
Da gegensätzliche Ladungen sich anziehen, wandern die Zn2+-Ionen zum bei eingeschalteter Stromquelle negativ geladenen Nagel. Wenn sie dort ankommen, nimmt jedes Zink-Ion zwei Elektronen aus der wartenden Menge auf. So entsteht ein ungeladenes Zink-Atom:
Und viele Zink-Atome, die sich übereinander stapeln, bilden das Metall Zink. So bekommt der negativ geladene Stahlnagel mit der Zeit einen Überzug aus Zinkmetall. Zum Glück leitet auch das Zinkmetall elektrischen Strom, sodass aus der Stromquelle nachfolgende Elektronen einfach hindurchdringen und weitere Zink-Ionen ergänzen (Chemiker sagen „reduzieren“) können.
Wenn das an allen Stellen der (verzinkten) Nageloberfläche gleichmässig geschähe, würde die Zinkschicht einfach immer dicker. Tatsächlich läuft der Prozess aber keineswegs so gleichmässig ab. Vielmehr bilden einzelne Zinkatome, die sich auf der vormals glatten Stahlfläche ablagern, eine raue Oberfläche voller Vorsprünge und „Noppen“. Für die nachfolgenden Zink-Ionen ist der Weg zu diesen vorspringenden Atomen bzw. Atomgruppen kürzer als der bis ganz zur Stahloberfläche. So lagern sich sich aussen auf diesen „Noppen“ ab, bevor sie den eigentlichen Nagel erreichen: Die betreffenden „Noppen“ wachsen weiter und werden zu Ästen, von denen ausgehend bald weitere Ästchen wachsen. Mit der Zeit entstehen ganze filigrane „Bäumchen“ aus Zinkmetall.
Und woher kommt das Chlor (bzw. Iod)?
Während die Zink-Ionen zum negativ geladenen Nagel wandern, wandern die Chlorid-Ionen (Cl–) zum positiv geladenen Nagel. Dort gibt jedes Cl–-Ion ein Elektron an den Nagel ab, um den Mangel darin auszugleichen. So entsteht ein ungeladenes Chlor-Atom. Da aber nicht gern allein sind, tun sie sich zu Paaren zusammen, die durch eine Atombindung zusammengehalten werden:
Mit Iodid-Ionen (I–) verhält es sich ganz genauso:
Der entscheidende Unterschied ist, dass Chlormoleküle (Cl2) bei uns angenehmer Temperatur ein Gas bilden, Iodmoleküle (I2) aber einen Feststoff (oder sie lagern sich an weitere Iodid-Ionen an und bleiben als „I3–“ im Wasser gelöst).
Wieviel Spannung muss die Stromquelle hergeben, damit die Zinkbäume wachsen?
Wenn ihr ein Netzteil mit Dreh- oder Schieberegler (z.B. einen Eisenbahntrafo) verwendet und diesen langsam aufdreht, werdet ihr feststellen, dass an euren Nägeln bei ganz langsamer „Fahrt“ nichts passiert. Es braucht also eine gewisse elektrische Spannung – also eine gewisse Grösse des Unterschiedes zwischen den Elektronenvorräten – damit die oben genannten Reaktionen wirklich ablaufen. Wie kommt das?
In dem Moment, da die ersten Zink-Ionen zu Zink-Atomen werden, stehen Zink-Ionen und Zinkmetall in direktem Kontakt. Das ist die gleiche Situation, wie ihr sie z.B. von Kartoffelbatterien kennt. Auch am anderen Nagel gibt es solch eine Gegenüberstellung. Mit anderen Worten: Mit dem Beginn des Experiments werden beide Nägel zu den Polen einer Batterie! Und die will ihren Strom in genau der entgegengesetzten Richtung liefern wie eure eigentliche Stromquelle.
Eure Stromquelle muss also gegen die „Nagelbatterie“ in eurem Versuchsgefäss anarbeiten. Damit der Strom in die Richtung fliesst, in die ihr ihn haben wollt, muss die Stromquelle also mehr Spannung liefern als die „Nagelbatterie“. Wieviel mehr, das haben fleissige Forscher unlängst ausgemessen:
Wenn ihr eure Zinkbäumchen aus Zinkchlorid züchten möchtet, benötigt ihr mindestens 2,3 Volt, wenn ihr stattdessen lieber mit Zinkiodid arbeitet, sollten schon 1,3 Volt genügen. Zumindest in der Theorie. Tatsächlich hängt diese sogenannte „Zersetzungsspannung“ auch von eurem Versuchsaufbau ab. Schlecht gelötete Kontakte, lange Leitungen und ähnliches können dazu führen, dass ihr etwas mehr als die Zersetzungsspannung braucht. Mein Eisenbahn-Trafo liefert jedoch bis zu etwa 15 Volt, ein Batterieblock mit vier AA-Batterien 6 Volt und eine 9 Volt-Batterie was draufsteht. So habt ihr mit solchen Stromquellen in jedem Fall genügend Spannung zur Verfügung.
Entsorgung
Wenn ihr unbenutzte Zinksalz-Lösung übrig habt, könnt ihr sie in einem dicht verschlossenen Behälter aufbewahren und für spätere Versuche benutzen. Die Zinkbäumchen sind leider sehr zerbrechlich und lassen sich kaum im Ganzen aufheben. Sie bestehen aber aus reinem Zinkmetall, dass ihr ebenfalls sammeln und für andere Versuche nutzen könnt.
Gebt etwas Natriumthiosulfat (ein kristalliner Feststoff) in die Versuchslösung, nachdem ihr die Nägel herausgenommen habt. Dieser Stoff reduziert allenfalls noch vorhandenes Chlor bzw. Iod wieder zu Chlorid- bzw. Iodid-Ionen. Damit sind die gefährlichsten Abfälle bereits beseitigt.
Reste der gebrauchten (und reduzierten) und der ungebrauchten Lösung dürfen dennoch nicht in den Abfluss! Sie sind giftig für Wasserorganismen! Entsorgt beide an einer Sondermüll-Sammelstelle (wenn ihr ein Schullabor mit Entsorgungssystem habt: In den Behälter für anorganische Salze und Schwermetalle).
Und habt ihr schon einmal Zink- oder andere Metallbäume gezüchtet? Welche Erfahrungen habt ihr gemacht?










