Kampf gegen Staub: Wirken Antistatik-Sprays?
Schon wieder Staub wischen – wer kennt das Problem nicht? Wohl kaum einer. Deshalb haben zahlreiche Hersteller von Reinigungs- und Pflegemitteln Antistatik-Sprays im Angebot. Diese Mittel sollen – einfach aufgesprüht – dafür sorgen, dass sich weniger Staub auf den Oberflächen in unserem Zuhause absetzt. So müssten wir dann weniger Staub wischen.
Aber was taugen solche Sprays wirklich? Wie funktionieren sie? Und kann man sie auch selber herstellen?
Wie kommt der Staub ins Haus?
Staub im Haus ist etwas ganz normales und überdies unvermeidlich. Grossteils besteht er aus winzigen Hautschuppen von uns und, wenn vorhanden, unseren Haustieren. So lange wir leben, erneuert sich unsere Haut ständig, sodass wir laufend solche Schuppen verlieren.
Dazu kommen Klein- und Kleinstlebewesen, deren Überreste und Ausscheidungen. Auch die sind ganz normal: Selbst der sauberste Haushalt kommt nicht ohne Hausstaubmilben, Einzeller, Spinnen (und Spinnweben) sowie viele andere kleine Mitbewohner aus. Dazu kommen Fasern, Fussel und anderer Abrieb von Textilien und Gegenständen, die wir tagtäglich daheim benutzen.
Auch von draussen tragen wir regelmässig Staub ins Haus: Abrieb von Strassen und Reifen, Pflanzenteilchen und wiederum Kleinstlebewesen. Beim Lüften kommen mit der ausgetauschten Luft Pollen und mehr (Saharastaub, Vulkanausbrüche…) oder weniger (Feinstaub durch Verkehr) natürlicher Staub aus der Luft hinzu.
Insgesamt bilden sich täglich rund 6 Milligramm Hausstaub pro Quadratmeter – oder 130 Gramm pro Person und Jahr! Dass wir regelmässig Staub wischen müssen lässt sich also nicht vermeiden. Es sei denn, es wäre uns gleich, wenn irgendwann alles zustaubt.
Das jedoch kann fatale Folgen haben. Wenn der Staub Lüftungsschlitze elektronischer Geräte verstopft, kann das zur Überhitzung und im schlimmsten Fall zu einem Brand führen. Und als wollten sie uns verhöhnen, ziehen gerade elektronische Geräte den Staub wie magisch an.

Warum ziehen Elektrogeräte besonders viel Staub an?
Staubpartikel gelangen von ihrem Entstehungsort zunächst in die Luft und werden in Strömungen und Wirbeln durch den Raum transportiert. Irgendwann folgen sie trotz ihres verschwindend kleinen Gewichts der Schwerkraft – oder anderen Kräften – und setzen sich auf Oberflächen ab.
Welche anderen Kräfte?
Staubpartikel bestehen aus Molekülen. Wenn solche Partikel von grösseren Gegenständen abgerieben werden, werden nicht nur ganze Moleküle voneinander getrennt. Auch die Moleküle selbst werden abgerieben: Sie büssen dabei Elektronen aus ihrer Hülle ein oder bekommen zusätzliche Elektronen, die von anderen Molekülen abgerieben wurden, aufgedrängt. Kurzum: Diese Moleküle, und damit auch die Staubpartikel, zu denen sie gehören, werden elektrisch geladen.
Und das werden elektronische Geräte auch. Das liegt in der Natur ihrer Funktionsweise: Sie arbeiten mit elektrischem Strom. Das heisst, in ihnen werden Ladungen hin und her geschickt und hier und da gesammelt. Und die Funktionsweise mancher Geräte, zum Beispiel Laserdrucker, beruht sogar darauf, dass bestimmte Bauteile ganz gezielt elektrostatisch aufgeladen werden.
Nur halten sich elektrische Ladungen kaum an Spielregeln oder Grenzen. Stattdessen drängen sie in jeden Stoff in ihrer Umgebung, in welchem sie sich halbwegs bewegen können. So bleibt es nicht aus, dass einige Ladungen in der Aussenverkleidung der Geräte landen. Und wenn in deren Nähe Staub in der Luft vorbeikommt, der zufällig entgegengesetzt geladen ist, ziehen sich die unterschiedlichen Ladungen gegenseitig an. Da die Ladungen in der Geräteoberfläche nicht hinaus können, gibt der fast gewichtslose Staub der Anziehung nach und landet auf dem Gerät.
Was kann man dagegen tun?
Um die vermehrte Anziehung von Staub zu verhindern, müssen die elektrischen Ladungen von der Geräteoberfläche fortgeschafft werden. Das Problem dabei: Die übliche Aussenverkleidung von Elektrogeräten besteht aus nichtleitendem Kunststoff (Verweis PBA). Das heisst, Ladungen, die dort einmal hineingeraten sind, finden kaum bis gar nicht wieder hinaus.
Ein extremes Beispiel ist Polystyrol („Styropor“). Nicht umsonst verwende ich dieses Material beim Erzeugen von Miniatur-Blitzen im DIY-Experiment: Es lässt sich durch Reibung stark elektrostatisch aufladen und gibt die Ladung erst ab, wenn ein elektrischer Leiter (wie die Aluschale im Experiment) in seine unmittelbare Nähe gelangt.
Findige Chemiker und Techniker haben jedoch zwei Wege ersonnen, um den Ladungen das Entkommen aus solchen Materialien zu erleichtern. Beide beruhen darauf, dass die Leitfähigkeit der jeweiligen Oberfläche erhöht wird – indem eigens für den Abfluss von elektrischen Ladungen Wege geschaffen werden.
1. Leiter in die Oberfläche einbauen oder darauf aufbringen
Am naheliegendsten ist vielleicht, eine Metallschicht auf die Kunststoffoberfläche aufzubringen. Metalle sind sehr gute elektrische Leiter und sorgen für einen regen Ladungsverkehr. Andererseits sind sie oft anfällig für Korrosion – und jene, die das nicht sind, sind meist teuer. Ausserdem verändern sie das Aussehen der Kunststoffoberfläche.
Deshalb gibt es viele weitere sogenannte leitende Antistatika, die direkt in das Material hineingemischt werden. Das können Metallpulver sein, die mit Lacken vermengt werden, oder Metallfäden bzw. Leitfähigkeitsruss, die mit einem Kunststoff gemischt werden. Diese Stoffe, insbesondere Russ, sind jedoch tief schwarz und dementsprechend an der Oberfläche sichtbar. Freunde unverändert farbiger Oberflächen haben daher eigens leitfähige Polymere wie PEDOT ersonnen.
Ein leitfähiger Kunststoff ohne Farbe
PEDOT steht für „Polyethylendioxythiophen“ und sieht so aus:
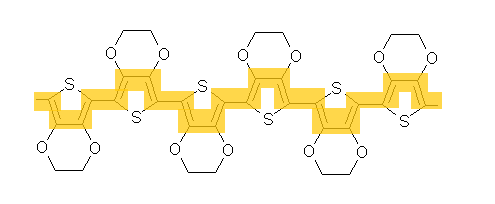
Wie alle Polymere besteht auch dieser Stoff aus langen Kettenmolekülen, die aus sich immer wiederholenden „Gliedern“ zusammengesetzt sind. Die PEDOT-Moleküle haben dabei eine Besonderheit: Entlang ihrer Ketten wechseln sich C-C-Einfach- und C-C-Doppelbindungen stets ab. Tatsächlich ragt die zweite Bindung (die sogenannte „Pi-Bindung“) einer Doppelbindung, die wie eine Hülle um die erste liegt, an beiden Enden über die eigentliche Bindung hinaus, sodass es zu einer Überlappung mit dem Ende der Doppelbindung am Nachbaratom kommt.
So können die Elektronen der äusseren Bindung sich in die nächste äussere Bindung bewegen und umgekehrt. Entlang sich abwechselnder Einzel- und Doppelbindungen kann also ein Strom fliessen: Die Molekülkette ist also nichts anderes als ein winziges Stromkabel!
Wenn man diese Polymerketten mit anderen mischt, erhält man leitfähige Kunststoffe – zum Beispiel Lack, den man auf eine Oberfläche auftragen kann. Wirklich raffiniert wird PEDOT aber erst dadurch, dass es in einer dünnen Lackschicht farblos erscheint. Die meisten Moleküle, die miteinander vernetzte Pi-Bindungen enthalten, sind nämlich farbig (auch Lebensmittelfarbstoffe, wie sie zum Färben von Ostereiern verwendet werden, zeichnen sich durch derartige Netzwerke aus). PEDOT wirkt dagegen erst in dickeren Schichten bläulich. So kann man damit Oberflächen leitfähig machen, ohne dass sich ihre Farbe ändert.
2. Nichtleitende Antistatika ein- bzw. aufbringen
Ob nun Metall, Russ oder leitfähige Kunststoffe – die Verarbeitung dieser leitenden Antistatika ist immer mit Aufwand und Mehrkosten verbunden. Deshalb verwendet man sie vornehmlich da, wo es nicht anders geht: Zum Schutz von speziellen elektronischen Bauteilen, denen aufgestaute Ladung bzw. zu schnell abfliessende Ströme gefährlich werden können.
Im Alltag verwenden wir, wenn wir es für nötig erachten, stattdessen sogenannte nichtleitende Antistatika. Die bestehen aus einfachen, kleineren Molekülen, die leicht zu handhaben und an ihren Einsatzort zu bringen sind. Aber halt:
Wie können Nichtleiter Strom leiten?
Würden Nichtleiter Ladungen, also elektrischen Strom leiten können, wären sie schliesslich keine Nichtleiter. Deswegen brauchen die Nichtleiter im Antistatik-Einsatz Hilfe von einem leitfähigen Stoff: Wasser. Eigentlich ist reines Wasser nur wenig leitfähig, aber es bietet darin gelösten Ionen immerhin die Möglichkeit, sich frei zu bewegen. Und Ionen sind nun einmal geladene Teilchen. Wasser mit darin gelösten Ionen eignet sich daher prima, um unerwünschte Ladungen abzutransportieren.
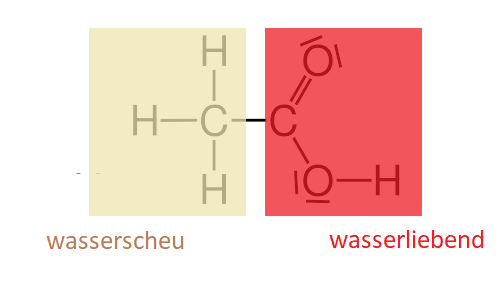
Nur kann man mit Wasser nicht einfach Kunststoffe lackieren – zumal die meisten Kunststoffe Wasser nicht mögen – sie sind „hydrophob“ (das ist altgriechisch für „wasserscheu“) – und daher die meisten Wechselwirkungen mit dem kühlen Nass verweigern. So auch den Austausch elektrischer Ladungen.
Hilfreich: Die Superkräfte von Tensiden
Wenn ihr euch schon mit der Superwaschkraft von Seifen beschäftigt habt, kennt ihr dieses Problem wahrscheinlich schon: Wasserscheue (und damit gleichzeitig fettliebende) Stoffe verweigern die Zusammenarbeit mit Wasser. Abhilfe durch Molekül-Diplomatie schaffen da Tenside, die besonderen Moleküle, aus denen Seife besteht.
Besonders sind Tensid-Moleküle deshalb, weil sie – ähnlich wie Streichhölzer – aus zwei ganz unterschiedlichen Teilen bestehen: Einem wasserliebenden „Kopf“ und einem fettliebenden „Schwanz“. Da fettliebende Moleküle nur mit anderen Fettliebenden und wasserliebende Moleküle nur mit anderen Wasserliebenden verkehren wollen, sind solche „Zwitter“ die perfekten Vermittler.
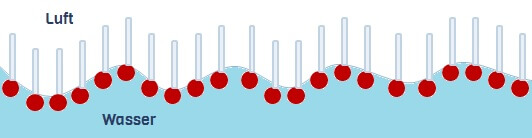
Geraten Tenside nämlich zwischen Wasser und einen fettliebenden Stoff, so richten sie ihre Köpfe zum Wasser aus und ihre Schwänze zum fettliebenden Material. Köpfchen in das Wasser, Schwänzchen in die Höh‘! So können Tenside mit beiden Stoffsorten wechselwirken – und das auch noch gleichzeitig. Über so geschaffene „Brücken“ können auch elektrische Ladungen den Weg vom unwegsamen Kunststoff ins bewegliche Wasser finden.
Antistatik-Sprays enthalten Tenside
Um eine Oberfläche leitfähig und damit passierbar für elektrische Ladungen zu machen, kann man also einfach Tenside mit Wasser aufsprühen (oder sie als Zusatzstoff in den Kunststoff einarbeiten). Deren wasserscheue Schwänze haften daraufhin an der Oberfläche, während die wasserliebenden Köpfe für den gewünschten Ladungsaustausch mit dem Wasserfilm darüber sorgen.
Die Wirkung von Antistatik-Sprays hat Grenzen
Der Wirksamkeit von antistatischen Tensiden zum Aufsprühen sind damit allerdings zwei einfache, aber kaum überwindbare physikalische Grenzen gesetzt:
- Die Wechselwirkungen zwischen den Molekülen, die zum Haften der Tenside an der Oberfläche führen, sind im Vergleich zu chemischen Bindungen ziemlich schwach. So genügt schon ein wenig Reibung, um die aufgesprühte Schicht wieder zu entfernen. Selbst Luftreibung führt dazu, dass die aufgesprühte Schicht mit der Zeit wieder abgetragen wird.
- Die Antistatik-Schicht funktioniert nur so lange, wie sie genügend Wasser enthält. Dass ein Grossteil des mit Antistatik-Spray aufgesprühten Wassers verdunstet, ist so gewollt. Wenn aber die Raumluft zu trocken ist, verdunstet bald zu viel Wasser, sodass die allein gelassenen Tenside ihre Wirkung nicht mehr entfalten können.
Und dann ist da noch die Schwerkraft: Staubteilchen, die von oben herabsinken, werden von Antistatika keineswegs abgelenkt, sondern fallen letztlich da hin, wo ihr Weg nach unten eben endet.
So können Antistatik-Sprays nur vorübergehend und unter den richtigen Bedingungen Wirkung zeigen. Nützliche Helferlein, um im Zimmer die Luftfeuchtigkeit hoch zu halten, sind Pflanzen, Zimmerbrunnen oder im Winter Wasserschalen auf der Heizung. Für solche sind Antistatik-Sprays kein Ersatz, sondern allenfalls eine Ergänzung.
Antistatik-Sprays zum Selbermachen: Was taugen die?
Wenn schon die Wirkung so eingeschränkt ist, lohnt sich dann womöglich teures Antistatik-Spray mit all seinen Inhaltstoffen aus der chemischen Industrie? Oder kann man das auch selber machen?
Viele Seiten, die sich mit nachhaltiger Lebensweise und DIY-Reinigungsmitteln beschäftigen, meinen: Ja. Und geben mehr oder minder unterschiedliche Rezepte an. Insgesamt finden sich neben Wasser vier Bestandteile immer wieder. Doch wie sinnvoll sind die?
Flüssigseife
Enthält Tenside für die Superwaschkraft. Da diese Moleküle ebenso den Austausch von Ladungen zwischen nichtleitenden Oberflächen und Wasser bzw. feuchter Luft ermöglichen sollen, macht diese Zutat noch am meisten Sinn. Inwieweit die als Seife gedachten Tenside solchen, die speziell für den Ladungsaustausch designt sein mögen, gleich kommen, bleibt allerdings offen.
Essig
Enthält Essigsäure – Tafelessig 3 bis 5%, der in der Schweiz gängige Haushaltsessig zum Putzen knapp 10% und Essigessenz bis zu 30%. Essigsäure ist eine Carbonsäure, die aus einem wasserscheuen Kohlenwasserstoffgerüst und einer wasserliebenden Säuregruppe* besteht.
*Besonders wasserliebend wird die Säuregruppe durch ihre Fähigkeit, ein H+-Ion abzugeben und als Carbonsäure-Anion (mit negativer elektrischer Ladung!) leicht mit dem Wasser zu wechselwirken.
Das klingt doch irgendwie nach einem Tensid. Allerdings sind die Essigsäuremoleküle sehr klein, sodass der Anteil der wasserscheu haftenden Wechselwirkung ziemlich gering ausfallen dürfte.
Andere Carbonsäure-Anionen mit längeren Kohlenwasserstoffgerüsten würden da womöglich bessere Dienste leisten. Allerdings haben die nächstlängeren Verwandten der Essigsäure einen weitaus unangenehmeren Eigengeruch (Buttersäure z.B. enthält zwei Kohlenstoff-Atome mehr als Essigsäure, aber die möchte wirklich niemand riechen!).
Ausserdem ist Essigsäure – eben eine Säure. Und Säuren reagieren gerne mit verschiedenen Stoffen – besonders dann, wenn sie ständig daran kleben und entsprechend viel Zeit dazu erhalten. Auf Marmor und Kalkstein sollte man zum Beispiel niemals Essig aufsprühen. Diese Gesteine werden nämlich von Säuren sehr leicht angegriffen. Doch auch andere Oberflächen könnten bei längerer Anwendung irgendwann mit unliebsamen Überraschungen aufwarten.
Olivenöl
Besteht hauptsächlich aus Neutralfetten, die auch Triglyceride genannt werden. In diesen Molekülen sind Fettsäuren – also meist besonders langkettige Carbonsäuren – an Glycerin gebunden.
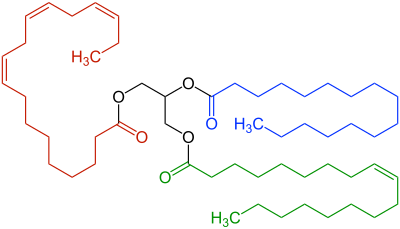
Diese Moleküle tragen von sich aus keine elektrischen Ladungen und sind weder besonders sauer noch basisch – daher der Name. Ausserdem sind sie fettliebend – und damit wasserscheu. Diese Eigenschaften machen frische Pflanzenöle so wenig leitfähig, dass z.B. Rapsöl als flüssiges Isoliermaterial in der Energie- und Hochspannungstechnik eingesetzt werden kann.
Olivenöl als Quelle für Tenside?
Carbonsäuren mit langen Kohlenstoffketten? Die gäben doch prima Tenside ab! Wenn sie denn ungebunden und elektrisch geladen wären. In der Verbindung mit Glycerin zum Fettmolekül, die zur Familie der Ester gehört, sind sie dagegen nur wasserscheue, ungeladene Seitenketten eines wasserscheuen Moleküls. Das kann man ändern, wenn man das Fett mit einer Base mischt, um die Moleküle zu zerlegen: So stellt man schon seit Jahrtausenden Seife her.
In Gegenwart von Essigsäure (wie in vielen Rezepturen für DIY-Antistatik-Spray) können Fettmoleküle zwar auch gespalten werden, doch entstehen dabei – anders als bei der „Verseifung“ mittels Basen – vollständige Carbonsäure-Moleküle anstelle von Carbonsäure-Anionen. Und die geben ihr H+-Ion in Gegenwart der Essigsäure auch nachträglich kaum ab.
Naturgemäss finden sich in Pflanzenölen also stets ein paar freie Fettsäuren. Besonders dann, wenn das Öl schon etwas älter ist. Dann hatten Mikroorganismen und andere äussere Einflüsse nämlich viel Zeit, um das ein oder andere Fettmolekül zu zerlegen. In Gegenwart von Essig werden jedoch kaum Fettsäure-Anionen, sondern fast nur ungeladene Moleküle vorliegen. Wenn unter diesen Fettsäuren solche mit einem penetranten Eigengeruch sind, wird leicht erkenntbar, was dieser Prozess bedeutet: Das Öl wird ranzig.
Warum dann Olivenöl?
Vermutlich zielen solche Rezepturen auf die Pflege von Holzoberflächen oder allgemein den Glanz eines Ölfilms ab. Ob der Einsatz deshalb sinnvoll ist, wage ich dennoch zu bezweifeln. Nicht nur, weil Speiseöle leicht ranzig werden und Mikroben Tür und Tor ins Holz öffnen (Holz- und Möbelexperten empfehlen deshalb technisch aufbereitetes Leinöl, das diese Probleme nicht mitbringt, zur Holzpflege).
Wenn das Antistatik-Spray überdies Flüssigseife enthält, wird zudem ein Grossteil der Tenside aus der Seife mit der Vermittlung zwischen Wasser und Olivenöl beschäftigt, was zu Lasten der eigentlichen Antistatik-Wirkung gehen dürfte.
Ätherische Öle
Wie bereits erwähnt, hat Essig einen Eigengeruch, den nicht jeder mögen muss. Deshalb sollen ätherische Öle dazu dienen, diesen Geruch mit einem angenehmeren Duft zu überdecken.
Generell bin ich keine Freundin von solchen Manövern, zumal der eigentliche Störenfried dabei nicht beseitigt wird. Stattdessen kommen beachtliche Mengen des erwünschten Duftstoffs zum Einsatz, um erfolgreich mit dem Störgeruch zu konkurrieren. Das erachte ich bei Stoffen, die Allergien hervorrufen können (und das können ätherische Öle wie viele andere Naturstoffe auch!), nicht eben als erstrebenswert.
Immerhin: Für den Einsatz in selbstgemachten Reinigungsmitteln könnt ihr ein Öl, das alle (!) Mitglieder eures Haushalts mögen und vertragen, selbst aussuchen.
Zusammenfassung
Die Entstehung von Hausstaub ist unvermeidlich, kann aber nicht nur lästig, sondern auch zum Problem werden. Sogenannte Antistatika sollen Abhilfe schaffen – als leitende Zusatzstoffe in nichtleitenden Kunststoffen oder Lacken in der Elektrotechnik, oder als schnelle Hilfe in Form von nichtleitenden Antistatika zum Aufsprühen.
Die Wirkung solcher Antistatik-Sprays beruht auf Tensiden, also seifenartigen Molekülen, die das Abfliessen von elektrischen Ladungen aus einer nichtleitenden Oberfläche in einen leitenden Wasserfilm fördern sollen. Das funktioniert jedoch nur bei ausreichender Luftfeuchtigkeit und bis die Tensidschicht abgerieben wird.
Trotzdem wird eine Vielzahl von Sprays gegen Staub verkauft und im Netz finden sich viele Rezepturen für Antistatik-Spray zum Selbermachen. Neben Wasser enthalten diese DIY-Produkte in der Regel Flüssigseife (mit Tensiden), Essig (Säure mit Eigengeruch und wenig Tensid-Eigenschaften, die gegenüber manchen Oberflächen aggressiv sein kann), Olivenöl (das ranzig werden kann und die Wirksamkeit der Seife aufhebt) sowie ätherische Öle (als – unter Umständen allergieauslösende – Duftstoffe bzw. zur Überdeckung des Essiggeruchs).
Fazit
Aus meiner persönlichen Sicht ist der eingeschränkte Nutzen von Antistatik-Spray den Aufwand (und das Risiko einer Beeinträchtigung der behandelten Oberflächen) nicht wert. Da wische ich lieber regelmässig Staub – mit einem feuchten Lappen oder Schwamm, sodass ich möglichst wenig davon wieder aufwirbele. So kann ich den Staub ebenso regelmässig ganz aus den Räumen entfernen. Denn so lange er sich nicht absetzt, erscheint mir das kaum möglich.
An der Wirksamkeit von gängigen DIY-Antistatik-Sprays wage ich aus Chemikersicht zu zweifeln. Deshalb gibt es hier auch kein eigenes Rezept. Insbesondere dann, wenn Seife (die ja eigentlich auf Wirksamkeit hoffen lässt) darin auf Speiseöl trifft. Aber auch Chemiker sind nicht perfekt. Vielleicht habe ich ja etwas übersehen?
Dann freue ich mich auf eure Hinweise und Erfahrungen in den Kommentaren und die Möglichkeit, diesen Artikel ggfs. zu überarbeiten.



















Diese Antistatiksprays gibt es ja schon ewig, aber vielleicht wurde nun eine neue Generation entwickelt – ich weiß es nicht. Wie du es auch vorträgst, ist ein nasser Lappen immernoch das beste Mittel gegen Staub. Denn ich schließe es nicht aus, dass man sich mit den Sprays wieder neue Probleme, z.B. Allergien einhandelt.
LG
Sabiene
Meine Rede :). Dass bei kommerziellen Antistatiksprays – wie bei eigentlich allen Reinigungsmitteln, besonders solchen, die Duftstoffe enthalten – die Möglichkeit des Auslösens von Allergien besteht, habe ich bloss nicht noch einmal extra erwähnt. Daneben lege ich Wert darauf, nicht zu vergessen, dass auch ätherische Öle in DIY-Produkten dieses Problem mit sich bringen können.
LG,
Kathi