Zu niedrige Abgaswerte hier, zu viel CO2 dort – manipulierte Computerdaten und gewaltige Schadenssummen…in allen Medien liest man seit Wochen von skandalösen Praktiken rund um Abgasmessung und -deklarierung beim Autobauer VW und anderen. Aber was ist eigentlich das Problem mit dem Autoabgas, und was wird da so zweifelhaft gemessen, dass daraus ein weltumfassender Skandal erwachsen konnte?
Als ich vor den Sommerferien meine Probe-Lektion zum Einstieg in die berufspraktische Lehrerausbildung antrat, ahnte noch niemand etwas von all dem Aufruhr. In der Unterrichtsstunde, die ich halten sollte, waren Luftschadstoffe, wie sie auch in Autoabgasen zu finden sind, das Thema. Der Plan war, im Unterricht diese Schadstoffe im Abgas eines Autos nachzuweisen. Da ich selbst kein Auto besitze, war ein Car-Sharing-Fahrzeug die Abgasquelle meiner Wahl – und die Spannung war besonders gross, als sich das angemietete Auto gleich vor dem Schulhaus als VW Golf Variant mit Dieselmotor und „AdBlue“-Label entpuppte. Denn als Enkelin eines lebenslangen VW-Mitarbeiters habe ich eine besonders enge Beziehung zu Fahrzeugen dieser Marke (in meiner Familie wird seit ich denken kann keine andere Marke gefahren). Würde mir solch ein modernes Auto überhaupt genügend Schadstoffe für den Nachweis liefern?
Entsprechend habe ich mir alle Mühe gegeben, allem modernen Abgas-Management zum Trotz eine ausreichende Menge an Schadstoffen zu sammeln (ein Müllsack am Auspuff bei laufendem Motor leistet da gute Dienste). Der Versuch – eine Farbreaktion zum Nachweis von Stickstoffoxiden – lieferte dann auch ein überwältigendes Ergebnis: Was rosa werden sollte, präsentierte sich quietschpink: Es hatte Stickstoffoxide satt!
Erst über zwei Monate später, als der VW-Skandal Ende September die ersten Schlagzeilen machte, kam mir jener Versuch mit ganz neuer Brisanz versehen wieder in den Sinn: War der so gelungene Nachweis tatsächlich auf gute Planung und geschickte Probenentahme zurückzuführen, oder hatte ich es schlichtweg mit einer weniger effektiv gereinigten Abgasen zu tun als angenommen?
Aber fangen wir am Anfang an:
Verbrennungsvorgänge im Motor und was dabei entsteht
In den Fahrzeugen auf unseren Strassen findet man zwei Typen von Verbrennungsmotoren, die mit Flüssigtreibstoff laufen.
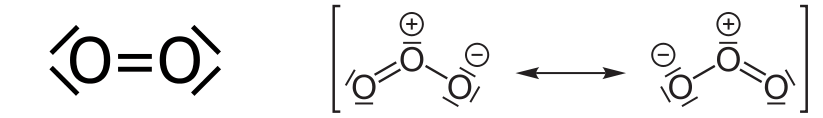
Der Ottomotor verbrennt Benzin, ein Gemisch aus relativ leichten Kohlenwasserstoffen – Molekülen mit rund um 7 Kohlenstoff-Atomen. Deshalb wird der Ottomotor in der Umgangssprache auch „Benzin-Motor“ genannt. Kohlenwasserstoffe sind hoch entzündlich und verbrennen, einmal angezündet, mit Luftsauerstoff im Idealfall zu Kohlenstoffdioxid und Wasserdampf:
Für einen vollständigen Reaktionsverlauf braucht es jedoch eine ideale Mischung der Ausgangsstoffe. Und die ist im engen Zylinder eines Ottomotors nicht gegeben. Dort gelangt nämlich nur eine vergleichsweise kleine Menge Sauerstoff hinein (mit voller Absicht, denn die Autobauer ziehen eine effiziente Motorleistung der perfekten Verbrennung vor). So werden nicht wenige der Kraftstoff-Moleküle auf „Sparflamme“ verbrannt, wobei anstelle des CO2 Kohlenstoffmonoxid, CO, entsteht.
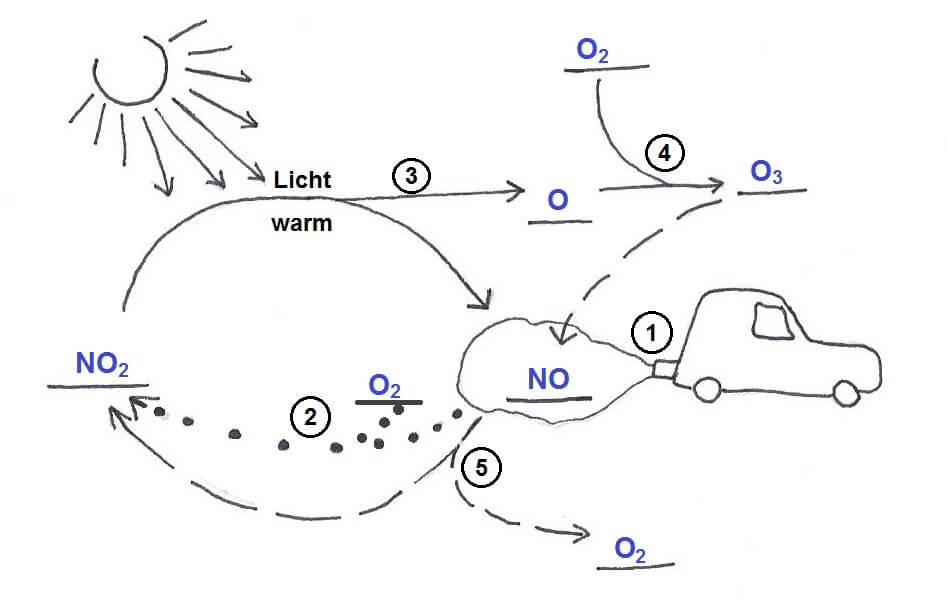
Die Verbrennung des Kraftstoffs setzt so viel Energie frei, dass sie – für kurze Zeit in einem engen Raum stattfindend – einen Kolben aus einem Zylinder drücken und damit den Motor in Bewegung versetzen kann. Leider wird dabei in der Enge des Zylinders zusätzlich eine grosse Menge Wärme erzeugt. Und leider ist der Sauerstoff nicht allein in unserer Atmosphärenluft. Einen sehr viel grösseren Anteil (70% der gesamten Luft) daran hat das Gas Stickstoff, N2, welches normalerweise sehr reaktionsträge ist und kein Problem darstellt. Im Ottomotor wird allerdings auf engem Raum so viel Energie freigesetzt, dass sogar der Luftstickstoff zu brennen anfängt. Und was dann entsteht, ist für Mensch und Umwelt höchst unangenehm. Um nicht zu sagen hoch giftig: Es entstehen Stickstoffoxide.
Im Dieselmotor wird anstelle von Benzin Dieselöl verbrannt. Auch dieses besteht aus Kohlenwasserstoffen und unterscheidet sich vom Benzin vor allem darin, dass seine Moleküle wesentlich grösser und schwerer sind: Sie enthalten um die 18 Kohlenstoffatome sowie entsprechend mehr Wasserstoff als die Bestandteile des Benzins. Die vollständige Verbrennung von Dieselöl liefert somit die gleichen Produkte wie die Verbrennung von Benzin, nur gibt ein Diesel-Molekül wesentlich mehr davon her – nachdem es mit wesentlich mehr Sauerstoff-Molekülen reagiert hat:
Um diese Reaktion mit dem nötigen Treibstoff zu versorgen wird der Kraftstoff im Dieselmotor mit wesentlich mehr Luft verbrannt als im Ottomotor. Mehr Luft bedeutet allerdings nicht nur mehr Sauerstoff, sondern auch mehr Stickstoff – also insgesamt mehr Moleküle, die zu Stickstoffoxiden reagieren können.
Warum diese Abgase giftig sind
Das Stickstoffmonoxid (NO) ist nicht sehr beständig – es reagiert schon bei „normalen“ Temperaturen mit weiterem Luftsauerstoff zu Stickstoffdioxid (NO2) weiter. Stickstoffdioxid ist ein braunes Gas, das unangenehm chlorähnlich riecht. Und dieses Gas hat es in sich. Es löst sich nämlich in Wasser, um dann sofort mit diesem zu Salpetersäure bzw. salpetriger Säure zu reagieren:
Stickstoffdioxid ist das gemischte Anhydrid (d.h. die wasserfreie Ausführung) von salpetriger Säure (HNO2) und Salpetersäure (HNO3).
Salpetersäure ist eine starke Säure (und salpetrige Säure steht ihr da in wenig nach) und überdies ein starkes Oxidationsmittel – wo sie entsteht, wirkt Salpetersäure ätzend und geht zudem eine Vielzahl von Redox-Reaktionen ein. Und Wasser gibt es in der Atmosphäre reichlich. Wenn Stickstoffdioxid auf die Wassertröpfchen in Wolken trifft, sind saure Wolken das Resultat, und aus sauren Wolken fällt saurer Regen. Dass der vielen Lebewesen nicht bekommt, wissen wir spätestens seit dem Waldsterben vor und in den 1980er Jahren.
Wenn Menschen (und Tiere) Stickstoffdioxid einatmen, trifft das Gas ebenfalls auf Wasser: Die Schleimhäute der Atemwege sind voll davon. Und wenn Stickstoffdioxid sich darin löst….niemand wird gern Säure in Bronchien und Lunge haben, zumal jeder sich vorstellen können wird, wie das beisst und kratzt und Husten auslöst (bei sehr hohen Konzentrationen eingeatmet führt das bis zu einem gefährlichen Lungenödem, weshalb Stickstoffdioxid als hochgiftig eingestuft wird!). Und dass Autoabgase genug Stickstoffdioxid enthalten können, um die Schleimhäute zu reizen, ist kein Geheimnis. Darüber hinaus gilt NO2 als krebserzeugend und ist an der Entstehung von Ozon in unserer Atemluft beteiligt. Es gibt also mehr als genügend Gründe, Stickstoffdioxid nach Möglichkeit zu meiden.
Kohlenstoffmonoxid (CO) ist ebenfalls giftig, wenn auch auf etwas andere Art und Weise. Dieses Gas kann nämlich – einmal eingeatmet – durch die Lunge in unser Blut gelangen (und davon merkt man in der Regel nichts, denn Kohlenstoffmonoxid ist farb- und geruchlos und wirkt nicht reizend). Dort bindet es an eben jene Bindungsstellen des roten Blutfarbstoffs, die für den Transport von Sauerstoff vorgesehen sind. Und anders als Sauerstoff lässt sich Kohlenstoffmonoxid so schnell nicht mehr davon lösen, sodass Sauerstofftransporter, die einmal Kohlenstoffmonoxid binden, für mehrere Stunden ausser Gefecht gesetzt sind. Bei einigen wenigen blockierten Bindungsstellen ist die Wirkung überschaubar – doch schon winzige Anteile an CO in der Atemluft genügen um die Sauerstoffzufuhr zu Zellen und Gewebe merklich lahm zu legen – im schlimmsten Fall mit Todesfolge.
Weitaus weniger unangenehm ist da des Kohlenstoffmonoxids nächster Verwandter, das Kohlenstoffdioxid. Dieses muss man schon in ausreichenden Mengen mit uns in einen engen Raum sperren, damit es den menschlichen Körper daran hindern kann sein selbst erzeugtes CO2 abzuatmen, sodass ein gefährlicher Rückstau im Atmungsvorgang entsteht. Viel grösser sind da die Schwierigkeiten, die uns Kohlenstoffdioxid in der Atmosphäre als Treibhausgas bereitet. Doch Treibhauseffekt und Klimaerwärmung sind langsame, langfristige Vorgänge, die weitaus weniger rasch zu bevölkerungsweiten Hilfeschreien führen als akute Vergiftungserscheinungen. So wird die Entstehung von Kohlenstoffdioxid anders als die Entstehung weitaus giftigerer Abgase in der Regel billigend in Kauf genommen.
Wie man die Freisetzung giftiger Abgase vermeidet
Im Laufe des 20. Jahrhunderts, als Strassenverkehr und industrielle Verbrennungsanlagen wie Kraftwerke immer zahlreicher wurden, bemerkte man rasch die Probleme, die eine allzu freizügige Abgabe giftiger Abgase mit sich brachte: Smog über Städten und Industriezentren, welcher besonders in Los Angeles berüchtigt war.
Aus Chemikersicht erscheint das Abgasproblem jedoch lösbar (zumindest weitgehend). Die verschiedenen giftigen Abgase, in den meisten Fällen Produkte „unvollständiger“ Reaktionen, haben nämlich eines gemeinsam: Ihre Moleküle enthalten nicht wenig Energie und würden durchaus weiterreagieren (und das nicht nur mit Blutfarbstoff und Körperwasser!), wenn sie denn könnten – d.h. wenn sie einen genügend energiereichen Tritt in den Hintern bekämen. Dieser „Tritt“, auch Aktivierungsenergie genannt, müsste jedoch stärker sein, als ein Verbrennungsmotor ihn bei wirtschaftlichem Betrieb leisten könnte (Energie ist schliesslich teuer). Für solche Fälle kennen die Chemiker (die vermutlich bei der Natur abgeschaut haben) jedoch ein wirksames Workaround: Wird unwilligen Reaktionspartnern der richtige Stoff beigegeben, eröffnet dieser Stoff ihnen neue Wege zur Reaktion – Wege, die so bequem sind, dass sie ohne zusätzlichen Energie-Tritt in den Hintern begangen werden können! Ein Stoff, der eine solche wegweisende Wirkung hat, wird Katalysator genannt.
Für Reaktionen mit Verbrennungsabgasen eignen sich Edelmetalle als Katalysatoren – das hatte man schon in den 1950er Jahren erkannt und ein Prinzip für die Reinigung von Autoabgasen entwickelt. Dummerweise verbot sich damals der Einsatz dieser Technik, da der damalige Ottokraftstoff Blei-Verbindungen zur Erhöhung der Klopffestigkeit enthielt – und Blei ist Gift für Edelmetallkatalysatoren: Es macht sie postwendend unbrauchbar. Erst als sich in den 1980er Jahren die Verwendung bleifreier Kraftstoffe zunehmend durchsetzte, begann der Abgaskatalysator seinen Siegeszug. Nachdem er Anfang der 1980er in den USA eingeführt worden war, war die Schweiz 1986 das erste europäische Land, das per Gesetz den flächendeckenden Einsatz von Katalysatoren vorschrieb. Deutschland setzte ein ähnliches Gesetz nach schrittweiser Einführung erst 1993 um.
Dass Abgaskatalysatoren, kurz KAT genannt, Mitte der 1990er neumodisch und im Rahmen der boomenden Umweltschutzbewegungen „in“ waren, mochte sich auch darin niedergeschlagen haben, dass eine Schulfreundin mir damals den Spitznamen „Kat Diesel“ verpasste (auch für Dieselmotoren gibt es Abgaskatalysatoren – die waren derzeit wohl noch neumodischer).
Gemeinsam ist allen Abgas-Katalysatoren die Art und Weise ihrer chemischen Hilfeleistung: Sie befinden sich hinter dem Motorenausgang in jenem Rohr, das letztendlich zum Auspuff führt, sodass die Abgase über das Edelmetall strömen können. Unerwünschte Moleküle können so mit den Atomen an der Metalloberfläche reagieren, bleiben daran haften und ihre Atome werden an Ort und Stelle neu zusammengefügt, ehe sie sich in harmloseren Verbindungen wieder auf den Weg durch den Auspuff nach draussen machen.
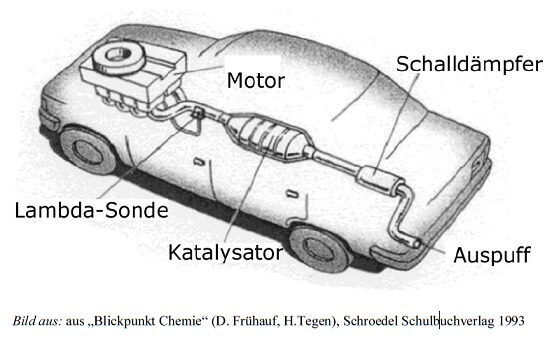
Im Einzelnen sind die verschiedenen Katalysatoren jeweils an „ihren“ Motorentyp angepasst.
Der Katalysator zum Ottomotor: Drei Wege zu sauberer(er) Luft
Die Abgase, welche aus einem Motor in Richtung Auspuff strömen, müssen innerhalb kurzer Zeit quasi im Vorbeiflug zu neuen Molekülen umgebaut werden. Da dieser Umbau nur an einer Edelmetall-Oberfläche stattfinden kann, liegt auf der Hand, dass diese Oberfläche grösstmöglich sein sollte, damit darauf möglichst viele Gasmoleküle gleichzeitig umgebaut werden können. Unglücklicherweise sind Edelmetalle sowohl unheimlich schwer als auch unheimlich teuer. Und weil weder zu hohe Kosten noch vermehrter Kraftstoffverbrauch durch zusätzliches Gewicht zu sauberer Luft beitragen, werden in einem Abgaskatalysator nur kleinstmögliche Mengen an Edelmetallen verbaut.
So ist das Herzstück des Katalysators ein Block aus Keramik, der aus wabenartig aneinander gelagerten Röhren besteht. Dieser Träger wird so in das Auspuffrohr eingebracht, dass das aus dem Motor strömende Abgas auf all diese Röhren verteilt den Block durchströmt. Um die überströmte Oberfläche weiter zu vergrössern ist die Innenfläche der Keramikröhren mit einer sandpapierartig rauen Schicht aus Aluminiumoxid bedeckt. Dieser Wash-Coat hat eine rund 7000 mal grössere Oberfläche als der Keramikträger als solcher. Das genügt um die durchströmenden Abgase in ausreichendem Umfang umzusetzen. Die gewünschten Reaktionen finden an einer hauchdünnen Schicht aus Platin und Rhodium (evtl. auch Palladium) statt, welche auf den Wash-Coat aufgedampft ist. Diese katalytisch aktive Schicht eines einzelnen KATs besteht aus insgesamt nur 4 bis 9 Gramm der Edelmetalle.
Damit der spröde Keramikträger im fahrenden Auto nicht zerbricht, ist er in eine wärmeresistente Dämmung (die Abgase, die frisch aus dem Motor kommen, sind heiss und müssen auch heiss sein, damit der KAT funktionieren kann!) aus Drahtgestrick oder Keramikfasermatten eingehüllt und von einem Stahlgehäuse ummantelt.
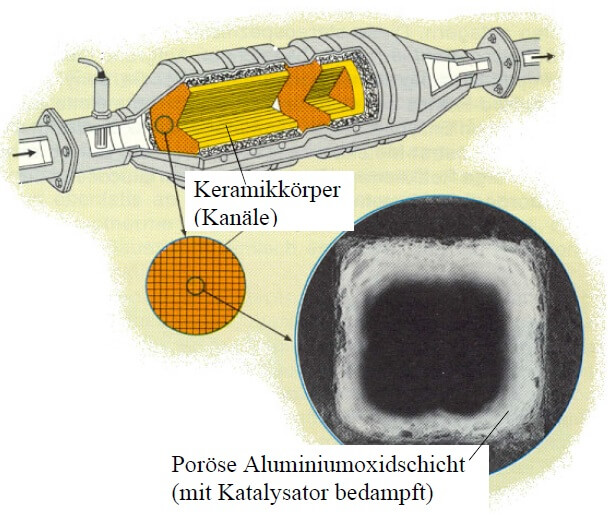
Aufbau eines Drei-Wege-Katalysators: Die heissen Abgase aus dem Motor strömen von links ein, vorbei an der von oben eingeführten Lambda-Sonde. Nach dem Durchströmen des Keramik-Trägers (gelb) treten die aufbereiteten Gase rechts wieder aus. (nach: Vortrag: Autokatalysator von Karin Hotz und Johannes Bösch, www.swisseduc.ch)
An der katalytisch aktiven Schicht können unter diesen Voraussetzungen drei verschiedene Reaktionen ablaufen. Bei allen handelt es sich um Redox-, also Elektronen-Übertragungs-Reaktionen. Die Elektronenabgabe, also die Oxidation, wird dabei jeweils vom Platin katalysiert (auf den energiearmen Weg gebracht), die Reduktion jeweils vom Rhodium.
- Stickstoffdioxid kann mit nicht oder nur teilweise verbrannten Kraftstoffresten zu Kohlenstoffdioxid, Stickstoff und Wasser reagieren. Kraftstoffreste sind verschiedene Kohlenwasserstoffe oder Bruchstücke davon, die ihrem Namen gemäss Kohlenstoff und Wasserstoff enthalten. Sie sind starke Treibhausgase und gelten, besonders wenn es sich um Benzol und andere aromatische Moleküle handelt, als krebserzeugend. Stellvertretend für alle unverbrannten Kohlenwasserstoffe steht in der folgenden Reaktionsgleichung Methan (CH4):
- Stickstoffdioxid reagiert mit Kohlenstoffmonoxid zu Kohlenstoffdioxid und Stickstoff:
- Kohlenstoffmonoxid kann mit verbleibendem Luftsauerstoff zu Kohlenstoffdioxid weiter oxidiert werden:
Diese drei Reaktions-„Wege“ haben dem Katalysator zum Ottomotor zu seinem Namen „3-Wege-Katalysator“ verholfen. Sie alle werden gleichzeitig begangen und führen dazu, dass der grösste Teil der giftigsten Abgase (rund 95%) zu harmloseren Stoffen umgesetzt wird. Der elementare Stickstoff N2 macht 70% unserer Atmosphäre aus, sodass sich neu entstehender Stickstoff nahtlos einfügt. Darüber hinaus bleiben die Produkte der vollständigen Verbrennung von Kohlenwasserstoffen.
Stattdessen wird die Verbrennung der Kohlenwasserstoffe quasi vervollständigt – so wie sie nach der Gleichung für den Idealfall ablaufen sollte.
Für den besten Umsatz: Vom ungeregelten zum Regel-KAT
Damit ebendies so reibungslos funktionieren kann, muss die Zusammensetzung des Abgasgemischs genau passend abgestimmt sein. Dazu ist am Eingang des Katalysator-Gehäuses die sogenannte Lambda-Sonde angebracht, eine Elektrode, die anhand der Gesetze der Elektrochemie den Sauerstoffgehalt des Abgases misst und über eine Elektronik an die Einspritzanlage des Motors meldet. So kann die Herstellung des Kraftstoff-Luft-Gemischs stets so geregelt werden, dass hinten genau das herauskommt, was der Katalysator für eine optimale Wirksamkeit braucht. Entsprechend werden mit einer Lambda-Sonde versehene Katalysatoren auch als „Regel-KAT“ bezeichnet.
Das Verhältnis von Kraftstoff zu Luft im Motor wird von den Automobil-Technikern übrigens Luftzahl genannt und mit dem griechischen Buchstaben λ (Lambda) abgekürzt – daran angelehnt erhielt die Sonde, die dieses Verhältnis regelt, ihren Namen.
Und für Dieselmotoren: DeNOx-Systeme
Um die schweren Diesel-Moleküle zu verbrennen, wird der Kraftstoff im Diesel-Motor mit einem wesentlich höheren Luft-Anteil als im Ottomotor verbrannt. Der darin enthaltene zusätzliche Sauerstoff wird aber wiederum nicht vollständig verbraucht, sodass auch im Abgas mehr Sauerstoff zu finden ist. Der „Marsianer“ Marc Whatney würde sagen: „Die Chemie ist eben eine unordentliche Schlampe…“. Und diese Schlamperei hat umständliche Folgen. Sauerstoff ist als Oxidationsmittel nämlich nicht nur für Verbrennungsreaktionen gut. In grösserer Menge sorgt er auch dafür, dass die Reduktion von Stickstoffdioxid zu im Diesel-Abgas nicht funktioniert.
Deshalb müssen für die vollständige Aufbereitung von Diesel-Abgasen stets mehrteilige Systeme eingesetzt werden, die unter anderem unter dem etwas schwammigen Begriff DeNOx-Kat bekannt sind (NOx steht dabei für verschiedene Stickstoffoxide).
Eine mögliche Kombination besteht dabei aus einem Oxidations-Katalysator (Oxi-Kat), der Kohlenstoffmonoxid und unverbrannte Kohlenwasserstoffe zu Kohlenstoffdioxid und Wasser „fertig“ verbrennen kann, und einem SCR-Katalysator. Das SCR steht für „selektive katalytische Reduktion“ – dieser Katalysator fördert also die Reduktion eines ausgewählten (selektierten) Abgas-Bestandteils: Die der Stickstoffoxide. Zusätzlich kommen bei Dieselfahrzeugen Russpartikelfilter zum Einsatz, da die Verbrennung von Dieselöl nicht molekulare Kohlenwasserstoff-Reste hinterlässt, sondern auch grössere, stark kohlenstoffhaltige Rückstände, die gemeinhin als Russ bekannt sind und ebenfalls nicht in unsere Atemluft gehören.
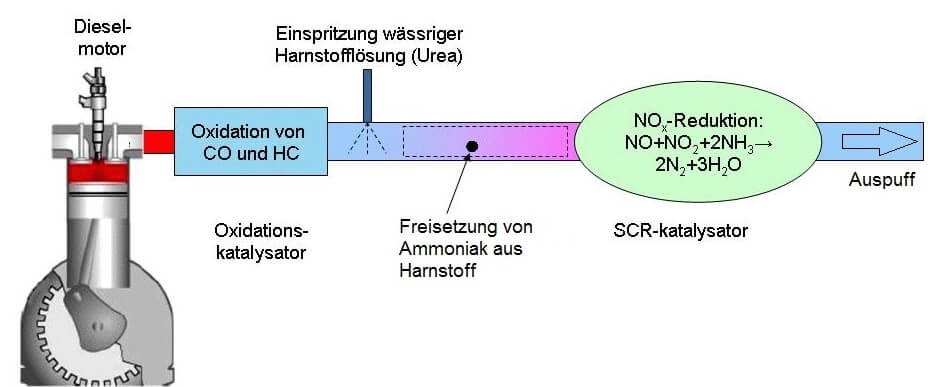
Aufbau eines DeNOx-Systems: Die heissen Abgase aus dem Dieselmotor strömen von links zunächst durch den Oxidations-Katalysator. Von CO und unverbrannten Kohlenwasserstoffen befreit wird ihnen anschliessend verdampfende Harnstofflösung zugesetzt, aus welcher auf dem Weg zum SCR-Katalysator Ammoniak entsteht. Beim Durchströmen des SCR-Kats reduziert dieser Ammoniak die Stickstoffoxide, ehe die aufbereiteten Gase rechts wieder austreten. (nach: „Diesel tech“ von Hastdutoene – Lizenziert unter CC BY-SA 3.0 über Wikimedia Commons.)
Die Reaktionen im Oxi-Kat entsprechen der vollständigen Verbrennung von Kohlenwasserstoffen sowie dem dritten Weg des 3-Wege-Kats zur Oxidation von Kohlenstoffmonoxid.
Im SCR-Katalysator werden schliesslich die Voraussetzungen geschaffen, um die Stickstoffoxide zu elementarem Stickstoff zu reduzieren. Da man den hinderlichen Sauerstoff nicht einfach verschwinden lassen kann, werden diese Voraussetzungen durch die Zugabe von Ammoniak als Reduktionsmittel geschaffen: Ammoniak drängt den Stickstoffoxiden die zu ihrer Reduktion nötigen Elektronen praktisch auf, ohne dass der überschüssige Luftsauerstoff ihn daran hindern könnte.
Entstickung mit Harnstoff
Da Ammoniak ein unangenehm riechendes, gesundheitsschädliches Gas ist, wird es nicht als solches im Auto mitgeführt. Stattdessen wird Harnstoff („Urea“, (NH2)2CO ) verwendet, ein ungefährlicher Feststoff, der bei Temperaturen über 133°C Ammoniak (NH3) freisetzt:
Das Nebenprodukt Isocyansäure (HNCO) reagiert mit anwesendem Wasserdampf weiter:
Harnstoff-Lösung in Wasser wird an Tankstellen unter dem Namen AdBlue verkauft (da Harnstoff bei der Düngemittelproduktion reichlich anfällt herrscht daran kein Mangel) und muss von Diesel-Fahrern, die einen SCR-Katalysator nutzen, regelmässig in einen gesonderten Tank nachgetankt werden.

Adblue tanken: Diesel-Zapfsäule mit Zusatz-Zapfhahn für Harnstofflösung (links) – und hier kommt die Lösung hinein… (rechts)(nach: „AdBlue Tankstelle“ von Beademung – Lizenziert unter CC BY-SA 3.0 de über Wikimedia Commons bzw. „Tankeinfuellstutzen AdBlue“ von Kickaffe (Mario von Berg) – Lizenziert unter CC-BY-SA 4.0 über Wikimedia Commons.
Das Ammoniak-Gas wird den Abgasen vor dem Eintritt in den SCR-Katalysator beigefügt, sodass es an der Oberfläche der katalytischen Schicht die Stickstoffoxide reduzieren kann:
Diese Reaktion läuft jedoch erst bei Temperaturen ab 250°C in nennenswertem Umfang ab. Bei zügiger Fahrt kommen die Abgase mit solch hohen Temperaturen aus dem Motor, sodass die Umsetzung im laufenden Fahrzeug kein Problem darstellt. Nach dem Anlassen eines kalten Motors muss dieser allerdings erst warm werden, ehe der SCR-Katalysator seine ganze Leistung bringen kann.
Genau darum wissend habe ich mich vor meinem Schulversuch bemüht, meine Abgase sofort nach dem Starten des Motors im Leerlauf zu sammeln (zur Erinnerung: Mein Test-Golf trug ein „AdBlue“-Label, welches das Vorhandensein eines SCR-Katalysators verrät). Das überragende Ergebnis bei dem Nachweis der Stickstoffoxide im gesammelten Abgas beweist daher zunächst, dass ich mich bei diesem Vorhaben ausreichend geschickt angestellt und meine Sammelaktion durchgeführt hatte, bevor Motor und Katalysator ihre Betriebstemperatur erreichen konnten.
Und worin besteht nun der Abgas-Skandal?
Der Teufel steckt in dem Computerprogramm, das die passende Zusammenstellung der Reaktionspartner in den Katalysatoren regelt. Diese Software ist in den betroffenen Fahrzeugen so geschrieben, dass sie erkennt, wenn das Auto auf dem Prüfstand einer Werkstatt einem Abgastest unterzogen wird. Daraufhin steuert die Software den Motor so, dass möglichst wenig Stickstoffoxide entstehen – ohne dass er dabei die im Strassenverkehr optimale Leistung bringt.
Die „Fähigkeit“ der Software einen Testlauf auf dem Prüfstand zu erkennen ist eigentlich für Autos entwickelt worden, die mit einem elektronischen Stabilitätsprogramm (ESP) ausgerüstet sind. Diese Funktion, die die Gefahr des Schleuderns (und seit dem „Elchtest-Debakel“ mit der Mercedes-A-Klasse 1997 auch das Umkippen) von Fahrzeugen vermindern soll, muss für den reibungslosen Ablauf von Untersuchungen auf dem Prüfstand nämlich vorübergehend abgeschaltet werden. Die Verwendung einer solchen „Abschalteinrichtung“ zum „Doping“ von Katalysatoren ist hingegen und nachvollziehbarer Weise verboten! Schliesslich sollen Abgastests ja die NO2-Freisetzung unter realen und nicht unter idealisierten Bedingungen prüfen.
Neben verbotenen, manipulativen Computerprogrammen ist jüngst ein zweiter Vorwurf laut geworden, bei welchem es um die CO2-Freisetzung geht. Dass der Einsatz von Katalysatoren die CO2-Entstehung bei der Kraftstoff-Verbrennung nicht vermindert, haben die Gleichungen für die katalysierten Reaktionen deutlich gezeigt. Da hilft auch Manipulation der Technik nicht weiter. So haben findige Rechen“genies“ offenbar schlichtweg falsche Angaben zur CO2-Freisetzung ihrer Fahrzeuge gemacht, um besser da zu stehen.
Das Problem dabei: In Deutschland fliesst die Freisetzung (Emission) des Treibhausgases Kohlenstoffdioxid (CO2) durch ein Fahrzeug in die Berechnung der dafür zu entrichtenden Kraftfahrzeug-Steuer ein. Fahrer, die sich ein vermeintlich emissionsarmes Auto angeschafft haben, müssen nach der Aufdeckung und Richtigstellung der entsprechenden Angaben nun mit unverhofft höheren Steuerabgaben rechnen. Da erscheint es mir nur recht und billig, dass VW sich bereit erklärt, diese Mehrkosten zu übernehmen.
Fazit
Abgas-Katalysatoren reinigen Verbrennungs-Abgase sehr effektiv von hochgiftigen Stoffen. Die Abgas-Freisetzung, insbesondere den CO2-Ausstoss, können sie jedoch nicht völlig verhindern. Eine möglichst effiziente Aufbereitung von Abgasen ist aufwändig und kostenintensiv. Immer strengere Auflagen für die Automobil-Hersteller und -Betreiber scheinen da geradezu zum „Schummeln“ zu verleiten.
Verbrennungsabgase entstehen übrigens auch bei der Herstellung von Strom und Komponenten für Fahrzeuge mit Elektromotoren. Der umweltbewussteste Weg von A nach B führt damit letztendlich über den Verzicht auf Kraftfahrzeuge wenn möglich, und damit über die Nutzung von Fahrgemeinschaften, öffentlichen Verkehrsmitteln oder der eigenen Füsse auf Velo und Gehweg.
Und welche Sorte Katalysator nutzt ihr?