Was passt besser zu Halloween als schaurig-schlabbriger Slime? Und am besten noch selbstgemacht? Dieser Gedanke liess mich in den letzten Tagen nicht los, sodass ich mich auf die Suche nach Anregungen für die Slime-Herstellung aus Haushaltszubehör gemacht.
Dabei habe ich festgestellt: Ich bin bei weitem nicht die Einzige, die auf solch eine Idee gekommen ist. Vielmehr wird das Netz von verschiedenen Slime-Rezepten und DIY-Videos geradezu überflutet. Und da jetzt noch ein Slime-Rezept auf den Markt werfen? Das erschien mir nicht gerade sinnvoll.
Allerdings fiel mir, vor allem in den Kommentaren auf Youtube und Co, noch etwas anderes auf: Viele der vorgestellten Slime-Rezepturen scheinen unter realen Bedingungen gar nicht zu funktionieren. Warum das so ist? Weil in der Regel weder die Blog-Autoren oder Video-Produzenten noch ihre Leser, die die Rezepte nachmachen, wissen, wie der spassige Schleim funktioniert. Chemisch gesehen. Wer das nämlich weiss, kann schon vor dem Ausprobieren abschätzen, was überhaupt nicht funktionieren kann.
Deswegen zeige ich euch heute, was Slime eigentlich ist und wie er entsteht – oder eben nicht. Ausserdem gebe ich euch solche Rezepte weiter, die wirklich funktionieren können. So könnt ihr euch möglichst frustfrei an die Herstellung von fantastisch gruseligem Schleim wagen!
Das Grundprinzip: Von der Flüssigkeit zum Slime
Schon vor zwei Wochen habe ich euch mit einem Experiment gezeigt, dass Flüssigkeiten aus vielen, vielen winzigkleinen Teilchen bestehen, die sich zwar dicht zusammenrotten, aber frei gegeneinander beweglich sind. Dieser Umstand ermöglicht es einer Flüssigkeit, sich der Schwerkraft folgend in einem Gefäss so auszubreiten, dass sie den Hohlraum darin ganz und vollkommen ausfüllt.
In dünnflüssigen Flüssigkeiten sind die Teilchen in der Regel klein und rollen ziemlich ungehindert aneinander vorbei. Manche Flüssigkeiten enthalten dagegen grössere Teilchen, meistens lange „Würmer“ aus einer Kette von Atomen. Solche Flüssigkeiten sind oft zähflüssig, denn die „Würmer“ verschlingen sich miteinander oder mit anderen Teilchen. Und wie bei einem Wollfaden-Salat wird ihre Bewegungsfreiheit dadurch eingeschränkt. So brauchen zähe Flüssigkeiten – wie zum Beispiel Speiseöl, Flüssigseife oder Klebstoff – länger, um sich in einem Gefäss vollständig zu verteilen.
Ein guter Slime ist dagegen schwabbelig, lässt sich kneten, formen und reissen, und haftet im Idealfall leicht an Oberflächen und Fingern, ohne sich dabei aufzulösen und Reste zu hinterlassen. In keinem Fall sollte er einfach zerlaufen!
Damit ist ein guter Slime keine wirkliche Flüssigkeit. Ein echter Feststoff ist er allerdings auch nicht – sondern etwas dazwischen. Tatsächlich besteht Slime teils aus fest miteinander verbundenen Teilchen, teils aus Teilchen im „flüssigen“ Zustand, die in einem Netzwerk aus den fest verbundenen Teilchen eingeschlossen sind. Ein solches Teilchengemisch nennt man landläufig ein „Gel“.
Aus welchen Stoffen kann man Slime herstellen?
Um die Zutaten für das Gel – also den Schleim – ordentlich miteinander mischen zu können, verwendet man dazu Flüssigkeiten und ggfs. Pulver. Ausgangstoff ist deshalb normalerweise eine Flüssigkeit (bzw. ein Flüssigkeitsgemisch), welches lange „Würmer“-Teilchen enthält. Dazu kommt ein Stoff, der mit diesen „Würmern“ reagieren und sie dabei zu einem Netz verknüpfen kann. Da das Ausgangs-Flüssigkeits-Gemisch in der Regel auch Wasser enthält, ist für kleine Flüssigkeitsteilchen zum Einschliessen ebenfalls gesorgt.
Das „Original“ aus den USA
Der Slime-Trend ist einmal mehr aus den USA über den grossen Teich zu uns geschwappt. Dort drüben ist es nämlich ziemlich einfach, die idealen Zutaten für DIY-Slime zu bekommen. Hier in der Schweiz bekommt man sie in Reinform allenfalls noch im Schullabor zu fassen – in den EU-Ländern sollte auch das heute nicht mehr möglich sein.
Rezept für DIY-Slime im Schullabor
Du brauchst:
– Polyvinylalkohol (PVA, PVAL), ein Feststoff aus Molekül-„Würmern“, der sich in heissem Wasser lösen lässt
– Borax (Natriumtetraborat), ein wasserlösliches Pulver
2g Polyvinylalkohol werden in 48ml heissem (90°C) Wasser, 2,5g Borax in 50ml lauwarmem Wasser gelöst. Beide Lösungen werden zusammengegeben und verrührt, bis ein Gel mit den gewünschten Eigenschaften entsteht – der Slime! (Eine ausführlichere Anleitung gibt es hier.)
Warum man Borax nicht mehr findet
Das Problem dabei: Borax und andere Verwandte der Borsäure können nach neuesten Forschungsergebnissen Ungeborene im Mutterleib schädigen und die Fortpflanzungsfähigkeit beeinträchtigen. Deshalb werden sie in den EU-Staaten (Deutschland und Österreich) nicht mehr an jedermann verkauft und aus den Schullabors verbannt.
Wenn du in der Schweiz, den USA oder anderen Ländern die Gelegenheit hast, im Labor mit Borax zu arbeiten, achte darauf, das Pulver nicht einzuatmen oder gar zu verschlucken. Wenn du ganz sicher gehen willst, trage Einmal-Handschuhe aus Nitril-Kautschuk (die blauen), um deine Hände zu schützen.
Was passiert bei der Reaktion?
Die „Würmer“-Moleküle des Polyvinylalkohols sehen so aus:
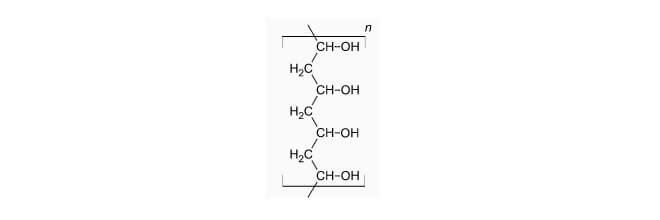
Das Bild zeigt einen Ausschnitt aus seiner sehr langen Kette aus Kohlenstoffatomen. An jedem „Glied“ dieser Kette sitzt noch ein Pärchen aus Sauerstoff und Wasserstoff. Diese OH-Gruppe ist kennzeichnend für einen Alkohol und kann mit anderen Stoffen reagieren.
Wenn man Borax in Wasser auflöst, entsteht daraus Borsäure, die zu ganz besonderen Teilchen weiterreagiert:
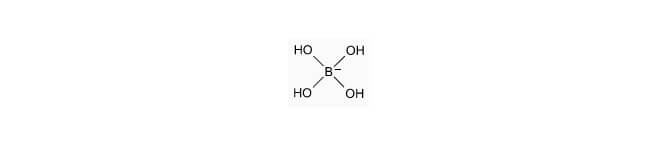
Diese Teilchen (sie heissen Tetrahydroxyborat) können nun mit den PVA-Würmern reagieren:
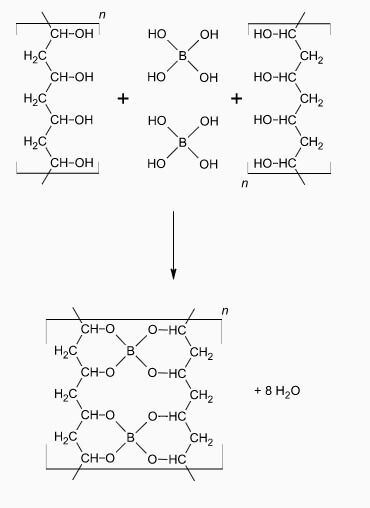
Dabei vereinigen sich die OH-Gruppen beider Teilchen zu festen Verbindungen, sodass die Borat-Anionen wie doppelköpfige Wäscheklammern zwischen den Würmern hängen und so zu „Knoten“ in einem Netz werden. Dabei bleiben Wasser-Teilchen übrig, die gleich als Füllteilchen im Gel Verwendung finden können.
Die PVA-„Würmer“ sind dabei keinesfalls steif, sondern in ihren Gelenken biegsam, sodass das Gel nicht hart wird, sondern sich eher wie ein vollgesogener Teilchen-Schwamm benimmt!
Wie du trotzdem daheim Slime machen kannst
Auch wenn man die Labor-Zutaten für guten Slime – ganz besonders Borax – nicht einfach kaufen kann, findet man sie in verschiedenen Haushaltszutaten.
Polyvinylalkohol findet man vor allem in verschiedenen Leimen und Klebstoffen. Zudem habe ich auf der Zutatenliste der Colgate-Zahncreme meines Mannes ein wahrscheinlich auch brauchbares „Würmer“-Molekül entdeckt.
Und obwohl Borax in Reinform nicht mehr erhältlich ist, findet man Borsäure und ihre Verbindungen in kleinen Mengen zum Beispiel in Kontaktlinsen-Flüssigkeiten oder Augentropfen. Auf der Liste der Inhaltstoffe können sie als „Borsäure“, „Borat“, „Borat-Puffer“ oder ähnlich erscheinen. Diese kleinen Mengen – zumal nur zum äusseren Kontakt mit dem Menschen bestimmt – sind nicht gefährlich, können aber für die Schleim-Herstellung reichen. Das Rezept für den funktionsfähigen Heim-Schleim findest du in diesem Video:
Die basische Rolle des Natrons
Wozu braucht es da das Natron (anders als von der Youtuberin vorgemacht wird das Wort auf der ersten Silbe betont und das „o“ kurz gesprochen)?
Das Geheimnis eines wirklich schaurig-schwabbeligen Schleims ist, dass die „Knoten“ im PVA-Borat-Netzwerk nicht besonders festgezurrt sind: Die Bindungen zwischen beiden lösen sich relativ leicht und können anderswo neu gebildet werden. So ist das Netzwerk in diesem Gel beim Kneten sehr wandelbar – was den Schleim erst richtig schleimig macht.
Da es sich bei den Bindungen zwischen PVA und Borat um sogenannte „Ester“ handelt – eine Verbindungssorte, die sich in der Gegenwart einer Base besonders leicht zerlegen lässt – vermute ich, dass die Youtuberin das Natron genau deshalb zum Einsatz bringt: Weil es eine Base ist. So macht es meiner Vermutung nach das Netzwerk besonders wandelbar – und den Schleim damit besonders schleimig.
Beim Experimentieren im (Schweizer) Schullabor habe ich nämlich gelernt: Wenn man nur genügend Borax mit dem richtigen Leim vermischt (ohne Base), erhält man statt schleimigem Slime elastische, springende Gummibälle (in denen die Netzwerk-„Knoten“ entsprechend fest gezogen und nicht mehr veränderbar sind)!
Andere Rezepte und warum sie nicht funktionieren
Einkomponenten-Schleime zum Tiefkühlen
Durch das Abkühlen werden die „Würmer“-Moleküle – zum Beispiel die Tenside in Seifen – in zähen Flüssigkeiten steif, sodass der Salat aus versteiften „Würmern“ Ähnlichkeit mit einem Netzwerk annimmt und das Ganze mitunter wie Schleim aussieht. Es entstehen allerdings keine festen Verbindungen zwischen den Molekülen. Das merkst du spätestens dann, wenn du die kalte Masse aus ihrem Behälter nehmen möchtest und sie sich eher wie eine Creme ähnlich verteilt. Ausserdem wird das Ganze wieder flüssig, sobald es warm wird.
Seife mit Salz oder Zucker
Seife enthält Fettsäurereste – das sind vergleichsweise kurze Teilchen-„Würmer“. Kochsalz (NaCl) besteht aus Ionen, die jeweils nur ein Atom enthalten. Damit lassen sich keine festen Bindungen zu zwei verschiedenen Atom-Ketten bilden. Dafür entzieht das Salz der Flüssigseife Wasser, was eine ursprünglich cremige Flüssigseife „schleimiger“ macht – aber wiederum nicht zu festen „Knoten“ führt.
Auch Zucker zieht Wasser an. Zudem enthalten Zucker-Moleküle einige OH-Gruppen, die möglicherweise zur Bildung von Ester-„Knoten“ geeignet sind. Also habe ich das ausprobiert und Spülmittel mit Zucker verrührt. Als ich ein bis drei Tropfen Haushaltsessig dazugegeben habe (die Gegenwart einer Säure kann die Entstehung von Estern fördern), ist tatsächlich ein „Glibber“ entstanden, der sich an meinem Rührstab festgeklammert hat. Aber wirklich brauchbarer Schleim wurde das nicht.
Kein Wunder: Schliesslich sind weder die Fettsäure- noch die Zucker-„Würmer“ auch nur annähernd so lang oder haben so viele Verbindungsmöglichkeiten wie PVA. Was immer ich da dazu gebracht habe, sich zu verbinden – das Ergebnis war allenfalls Möchtegern-Schleim.
Und wenn man für Borax einen Ersatz findet?
Manche Slime-Experimentatoren berichten, dass sie mit bestimmten Flüssig-Waschmitteln und PVA-haltigem Leim zum Erfolg gefunden haben (solchen Slime made in Switzerland gibt es hier). Ich habe mir die Inhaltsstoff-Liste eines solchen „geeigneten“ Waschmittels angesehen und verdächtige die darin enthaltenen „optischen Aufheller“, einen brauchbaren Ersatz für die Borat-„Knoten“ abzugeben. Die sehen nämlich (zum Beispiel) so aus:
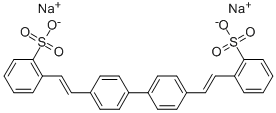
Anstelle der Bor-Sauerstoff-„Klammern“ enthalten diese Moleküle Schwefel-Sauerstoff-Gruppen (sogenannte Sulfonsäure-Gruppen), die ebenfalls für die Entstehung von Ester-Bindungen in Frage kommen.
Fazit
Wenn du wirklich brauchbaren Slime herstellen möchtest, brauchst du unbedingt lange, reaktionsfreudige Molekül-Würmer (sogenannte Polymere, z.B. Polyvinylalkohol) und eine Verbindung aus der Borsäure-Familie (z.B. Borat-Puffer) oder einen würdigen Ersatz dafür. Achte also beim Einkauf von Zutaten genau darauf, ob diese wichtigen Stoffe auf der Inhaltsstoff-Liste zu finden sind und probiere mit kleinen Mengen, ob das Ganze funktioniert – oder mache das Experiment (in der Schweiz) im (Schul-)Labor, wo du die Stoffe in Reinform in sicherer Umgebung verwenden kannst!
Entsorgung
Das gesundheitsschädliche Borax muss als Sondermüll entsorgt werden, Leim- oder Waschmittelreste gemäss den Angaben auf der Verpackung. Wenn Schleim-Reste Borax enthalten, gehören sie damit in den Sondermüll – denn der gefährlichste Bestandteil gibt bei der Entsorgung den Ton an!