Der Mai und Juni waren verregnet wie schon lange nicht mehr. Und das, nachdem viele von uns ihr liebstes Sommer-Fortbewegungsmittel längst aus dem Winterquartier geholt haben. Damit herrschen ideale Bedingungen für den grössten Feind von Autos, Fahrrädern, und was sonst noch so aus Eisen: Rost.
Bei anderen wiederum liegt Rost im Trend: Als schmucke Patina für Nützliches und Kunst in Haus- und Gartenbau. Und bei Frau Tonari und ihren Mitstreitern, die Ende jedes Monats eifrig Rostiges zur Rost-Parade zusammentragen. Und da bin ich dieses Mal auch dabei.

Rostig aber filigran: Dekoratives im Garten (Parque de Monserrate, Sintra, Portugal) CC-BY-SA 4.0 by Keinsteins Kiste
Aber wie es sich für eine Geschichte auf Keinsteins Kiste gehört, ist meine Geschichte vom Rost nicht nur ein Auszug unserer rostigen Entdeckungen der letzten Jahre, sondern auch ein Einblick in die Chemie dahinter: Was ist Rost eigentlich? Warum kann nur Eisen rosten? Warum gibt es so viel Rost an Schiffen? Wie kann man das eigene Eisen (in Form von Auto, Fahrrad, Gartentor und vielem mehr) vor Rost schützen? Und wie wird man ihn – wenn es dazu zu spät ist – wieder los?

Bestimmt mit Absicht rostig: Wer kennt den „Ritter Rost“? Das hier ist vielleicht sein Ross „Feuerstuhl“! (entlaufen in den Norden des Bundesstaats Oregon, USA) CC-BY-SA 4.0 by Reto Lippuner
Was ist Rost?
Rost mit einer chemischen Formel zu beschreiben ist längst nicht so einfach wie bei vielen anderen Stoffen. Das liegt daran, dass Rost nicht einfach „ein Stoff“ ist, sondern sich gleich aus mehreren zusammensetzt.
Eine chemische Formel für Rost, die dieses Stoffgemisch zu beschreiben sucht, lautet:
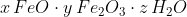
In Worten: Rost ist ein wasserhaltiges Gemisch aus verschiedenen Eisenoxiden. Bei den Eisenoxiden handelt es sich um Salze, also Stoffe, die aus Ionen bestehen. Diese verschieden geladenen Ionen werden von der elektrostatischen Anziehung in Kristallgittern zusammengehalten, die wir als atemberaubend regelmässige Kristalle sehen und in der Hand halten können. Beim Rost herrscht jedoch Uneinigkeit, was den Aufbau dieses Gitters angeht: Die Gitter von FeO und Fe2O3 sowie weiteren Sauerstoff-Verbindungen des Eisens sind sich so ähnlich, dass sie sich kreuz und quer durcheinander aufbauen und je nach äusseren Umständen ineinander übergehen. Und zu alledem sind auch noch Wassermoleküle in diesem Gitter eingeschlossen.
Diesen Umstand beschreiben die „*“-Zeichen in der Formel: Wenn die erste Formel einen Kristall beschreibt, beschreibt die Formel hinter dem „*“ ein Teilchen – meist ein Molekül – das auch noch in das Kristallgitter eingebaut ist. Wenn es sich dabei um Wasser handelt, nennen die Chemiker diese eingebauten Wassermoleküle „Kristallwasser“.
Tatsächlich beschreibt aber auch diese Formel „nur“ den Endpunkt verschiedener aufeinander folgender Entwicklungsstufen, die in echtem Rost alle nebeneinander vorliegen. Wie das vor sich geht?

Auf Lanzarote in einer sichtlich feuchten Höhle entdeckt: Eisenoxide einmal kosmisch CC-BY-SA 4.0 by Keinsteins Kiste
Wie entsteht Rost?
Die Entstehung von Rost ist ein besonderer Fall eines Vorgangs, der Korrosion genannt wird. Korrosion – das sind Reaktionen von elementaren Metallen (also ungeladenen Metall-Atomen) mit Stoffen in ihrer Umgebung.
Säurekorrosion
Die vielleicht simpelste dieser Reaktionen mag vielen aus der Schule wohlbekannt sein: Kommt ein Metall wie Eisen mit Säure in Berührung, werden Atome aus der Metalloberfläche gelöst und gehen als Ionen in die Flüssigkeit über. Dabei entsteht Wasserstoff, der in kleinen Gasblasen aufsteigt und beim Entzünden geräuschvoll verpufft.
)
Übrig bleiben nach dieser „Säure-Korrosion“ die Metallionen und die Anionen der ursprünglichen Säure (hier Chlorid-Ionen als Anionen der Salzsäure). Und wenn aus vormals ungeladenen Teilchen Ionen entstehen, sind zwangsweise Elektronen ausgetauscht worden (denn ein Austausch von Kernladung in Form von Protonen fiele – sofern möglich – in den Bereich der Kernphysik):
Die Metall-Atome geben Elektronen ab, die von der Säure stammenden H+-Ionen nehmen diese Elektronen auf. Chemiker nennen die Abgabe von Elektronen „Oxidation“ und die Aufnahme von Elektronen „Reduktion“. Das Metall wird also oxidiert, die H+-Ionen reduziert. Und dabei entstehen ungeladene Wasserstoffatome, die zu je zweien ein Wasserstoffmolekül bilden.
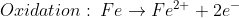
)
Sauerstoffkorrosion
Bei der Entstehung von Rost ist allerdings keine Säure im Spiel (zumindest keine stärkere als Wasser selbst). Anstelle von H+-Ionen sind dabei nämlich Sauerstoff-Moleküle für die Aufnahme von Elektronen zuständig, die in Folge ihrer Reduktion Oxid-Anionen bilden. Und Sauerstoff gibt es reichlich in der Luft. Da allerdings sowohl die entstehenden Eisen-Ionen als auch die Oxid-Ionen irgendwo hin müssen (und Luft kommt dafür nicht in Frage), funktioniert dieser Elektronenaustausch nur in Wasser, in welchem die verschiedenen Ionen in Lösung gehen können:
Wenn ein Wassertropfen eine Eisenoberfläche benetzt, können Eisenatome im Innern des Tropfens zwei Elektronen abgeben und sich als Fe2+-Ionen im Wasser von der Oberfläche fort bewegen. Die beiden abgegebenen Elektronen bleiben dabei zunächst in der Metalloberfläche zurück – welche sich somit negativ auflädt.
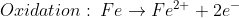
Auch Sauerstoffmoleküle können sich in Wasser lösen und so in einen Wassertropfen eindringen (Chemiker sagen „hinein diffundieren“), und zwar direkt aus der Luft durch dessen Aussenhaut. Wenn sie so am Rand des Tropfens in die Nähe der Eisen-Oberfläche gelangen, können sie dort überschüssige Elektronen aus dem Eisen aufnehmen.
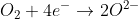
Da Oxid-Anionen (O2-) aber nicht einfach so in Wasser existieren können, läuft die tatsächliche Reaktion etwas anders:
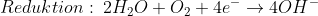
Das Hydroxid-Anion (OH–) ist im Prinzip nichts anderes als ein „unfertiges“ Oxid-Anion, das entsteht, wenn ein Sauerstoff-Atom neben zwei Elektronen auch noch ein H+-Ion aufnimmt (dieses H+-Ion wird jeweils von einem Wassermolekül abgegeben, wobei ebenfalls OH– entsteht. So bleibt für jedes Sauerstoff-Atom (anfangs je eins in beiden Wassermolekülen und zwei im Sauerstoffmolekül) am Ende ein Wasserstoff-Atom.
Und Hydroxid-Ionen können problemlos in Wasser existieren (tatsächlich sind sie sogar unverzichtbare Bestandteile von Wasser, aber das ist eine andere Geschichte).
Es entsteht also eine Lösung des Salzes Eisen(II)hydroxid. Die römische II, auch Oxidationszahl genannt, gibt dabei an, wie viele Elektronen das Eisen abgegeben hat.
_{2})
Eisen(II)hydroxid ist weisslich und nicht sehr beständig, denn Fe2+-Ionen geben leicht ein weiteres Elektron an Sauerstoff ab:
_{2}+O_{2}+2H_{2}O\rightarrow&space;4Fe\left&space;(&space;OH&space;\right&space;)_{3})
Das so entstehende Eisen(III)hydroxid ist schliesslich rostbraun. Dabei sind beide Eisenhydroxide wasserlöslich, sodass sich alle Ionen voneinander getrennt im Wasser bewegen können. Erst wenn das Eisen(III)hydroxid Wasser abgibt
_{3}\rightarrow&space;FeO(OH)\cdot&space;H_{2}O)
bildet sich schwerlösliches Eisen(III)oxid-hydroxid, das sich als fester Rost auf der Eisenoberfläche absetzt: Es entsteht ein Ionenkristall, in dessen Gitter die abgegebenen Wassermoleküle eingebaut werden, wie es die Formulierung mit dem „Mal“ andeutet. Folglich bleibt das „abgegebene“ Wasser dem Rost zunächst erhalten.
Aber auch das Eisen(II)hydroxid sowie das Eisen(III)oxid-hydroxid können Wasser abgeben:
2\rightarrow&space;FeO\cdot&space;H_{2}O)
\rightarrow&space;Fe_{2}O_{3}\cdot&space;H_{2}O)
Während die letzten drei Reaktionen untrennbar miteinander ablaufen, bilden sich zunehmend feste, aber stets spröde, sich abschuppende Beläge auf der Eisenoberfläche – allerdings nicht unbedingt dort, wo sich die Fe2+-Ionen von der Eisenoberfläche lösen! So ist der entstehende Rost dem Austausch von Ladungen, welcher für Redox-Reaktionen Voraussetzung ist, weder räumlich direkt im Weg, noch kann er eine luft-und wasserdichte Barriere bilden. Die Folge dessen: Ein Eisenstück, das ungeschützt Luft und Wasser ausgesetzt ist, rostet früher oder später durch.

Rost ist nicht sehr beständig und rinnt ungeniert auch über weisse Buchstaben (Valley of Fire State Park, Nevada, USA CC-BY-SA 4.0 by Reto Lippuner
Können Steine rosten?
Wer sich in der Natur aufmerksam umsieht, findet häufig Steine oder ganze Gesteinsschichten mit rostroten Verfärbungen. Und in manchen Gegenden sind sogar ganze Gesteinsmassive strahlend rot – wie zum Beispiel auf dem Colorado-Plateau im „wilden Westen“ Nordamerikas.

Balanced Rock: Rostige Steine im Arches Nationalpark, Utah, USA CC-BY-SA 4.0 by Reto Lippuner
Und tatsächlich können auch Steine rosten – nämlich dann, wenn sie Eisen enthalten. Dieses Eisen kann nämlich – meist im Zuge der Entstehung des jeweiligen Gesteins – zu verschiedenen Eisenoxiden reagieren, die als Bestandteile des Gesteins für die rote Farbe sorgen. Unter diesen Eisenoxiden kommt das Mineral Lepidokrokit dem „echten“ Rost am nächsten. Es wird mit der Formel γ-FeO(OH) beschrieben (das γ dient der Unterscheidung von anderen Kristall-Varianten mit der gleichen Verhältnisformel) und enthält im Unterschied zum „echten“ Rost kein zusätzliches Kristallwasser, was das Mineral relativ beständig macht.
Anstatt in sichtbaren Kristallen können Mineralien wie dieses auch feinkörnig in Gesteinen enthalten sein und die verschiedensten Steine rot färben – wie den Sandstein auf dem Colorado-Plateau oder Lava (eigentlich grau oder schwarz) an den Hängen der Vulkankegel auf Lanzarote.

Rostrote Lava-Schlacke im Timanfaya Nationalpark, Lanzarote CC-BY-SA 4.0 by Keinsteins Kiste
Was bewegt all diese Salze zum Umbau ihrer Kristalle?
Die gezeigten Reaktionen sind ausgewählte Vorgänge in einem System, in welchem sich ein chemisches Gleichgewicht einzustellen versucht. Das heisst, sie sind umkehrbar, und sobald sich das Gleichgewicht tatsächlich eingestellt hat, laufen die Reaktionen in entgegengesetzte Richtungen gleich schnell ab. Monsieur Le Châtelier erklärt auf dem Flughafen gern die Einzelheiten dazu.
Kurzum: Ein System im Gleichgewicht hat die Eigenheit, dass die Zugabe oder Entnahme eines daran beteiligten Stoffs zu einer Verschiebung des Stoffmengenverhältnisses im Gleichgewicht führt – und zwar derart, dass es dem Effekt durch die Zugabe oder Entnahme des Reaktionspartners ausweicht (das entspricht dem Prinzip von Le Châtelier, das auch Prinzip des kleinsten Zwanges genannt wird).
Mit anderen Worten: Wenn die rostige Eisenoberfläche langsam abtrocknet, das Wasser am Ort der Rostentstehung also verdunstet, werden Wassermoleküle, wie sie in den letzten drei Reaktionen entstehen, dem System entzogen. Dem Prinzip von Le Châtelier folgend sind diese drei Teilsysteme entsprechend geneigt, neue Wassermoleküle nach zu liefern (und so auch die ihnen vorangehenden Teilreaktionen, welche die dazu nötigen Ausgangsstoffe liefern, zu befeuern).
So entsteht eine ganze Kette von einander beeinflussenden Reaktionen, welche im Idealfall mit dem Gemenge kristallwasserhaltiger Eisenoxide endet, das die Formel x FeO • y Fe2O3 • z H2O vom Anfang zu beschreiben sucht.

Dampfmaschinenzug im Death Valley Nationalpark – Der Rost zeigt: Auch hier gibt es Wasser. Manchmal. CC-BY-SA 4.0 by Reto Lippuner
„Rosten“ auch andere Metalle?
Tatsächlich rosten kann natürlich nur Eisen – denn nur Eisen kann zu den rostroten Eisenoxiden reagieren. Korrodieren können hingegen auch viele andere Metalle. Einige haben dabei jedoch das Glück, dass ihre Hydroxide oder andere entstehende Salze nicht oder kaum wasserlöslich sind. So bilden sie sich direkt an der Metalloberfläche und bedecken diese bald lückenlos, sodass sie das darunter liegende Metall vor dem Einfluss von Wind und Wetter schützen. Zu den Metallen, die auf diese Weise gegenüber Wasser „passiv“, also unreaktiv werden, zählen Zink, Magnesium und Aluminium. Besonders Zink findet man häufig draussen, als Oberfläche von Leitplanken, Schildermasten und manchem mehr. Die hauchdünne Oxidschicht auf den Metalloberflächen lässt das ursprünglich glänzende Metall stumpf aussehen – aber dafür korrodiert es nicht!
In gewisser Weise rosten kann das Metall Mangan, das im Periodensystem gleich links vom Eisen zu finden ist. Mangan bildet eine ganze Reihe meist wasserhaltiger Oxide und Hydroxide, die in der Gruppe der „Braunsteine“ zusammengefasst werden. Die Braunsteine kommen in der Natur als Mineralien vor – darunter Manganit MnO(OH) und der im Endzustand wasserfreie Pyrolusit (MnO2 – richtig, Mangan kann auch 4 Elektronen abgeben!).
Für farbenfrohe Korrosionserscheinungen ist jedoch das Metall Kupfer sehr viel bekannter: Die vielerorts sichtbare grüne Patina auf Kupferdächern und Bronzeskulpturen (Bronze ist eine Legierung aus Kupfer und anderen Metallen (ausser Zink)) besteht jedoch nicht aus Kupferoxiden (die wären schwarz bzw. rot), sondern aus einem Gemisch verschiedenster Kupfersalze. Darunter können Kupfercarbonate (aus Reaktionen mit Kohlenstoffdioxid, CO2), -sulfate (aus Reaktionen mit Schwefeldioxid, SO2), vornehmlich am Meer Kupferchlorid (die Chloridionen liefert das Kochsalz im Meer, NaCl), Hydroxide (aus Reaktionen mit Sauerstoff und Wasser) und verschiedene Salze organischer Säuren sein.

Bronzener Kapitän auf rostigem Schiff: Kupfer bildet eine grüne Passiv-Schicht aus verschiedenen Salzen, Eisen rostet rötlich. (Cascais, Portugal) CC-BY-SA 4.0 by Reto Lippuner
Die häufig gehörte Bezeichnung „Grünspan“ für die grüne Schicht auf Kupfer und Bronze ist daher nicht ganz richtig. Denn Grünspan ist eigentlich der landläufige Name nur eines ganz bestimmten Salzes, nämlich des Kupfer(II)acetats, eines Salzes der Essigsäure.
Welche Metalle können an Luft und Wasser korrodieren? Gibt es da eine Regel?

Eine wahrhaft amerikanische Idee: Diese Versuchsreaktoren wurden geschaffen um Flugzeugturbinen anzutreiben. Atomgetriebene Flugzeuge? Hat nicht funktioniert – und jetzt rosten sie (EBR-1, Idaho State, USA) CC-BY-SA 4.0 by Reto Lippuner
Theoretisch kann jede Atom- oder Ionensorte Elektronen aufnehmen, doch ihr Bestreben danach ist sehr unterschiedlich stark. Grundsätzlich gilt dabei jedoch: Wenn unterschiedliche Atom- bzw. Ionensorten zusammenkommen, können die Atome oder Ionen, welche lieber Elektronen aufnehmen als ihre Reaktionspartner, Elektronen der anderen Atomsorte übernehmen: Der Partner, der stärker bestrebt ist Elektronen aufzunehmen, wird reduziert, der andere Partner wird oxidiert.
Das „Bestreben Elektronen aufzunehmen“ nennen Chemiker das Redox-Potential eines Teilchens – dargestellt als Paar von Teilchen vor und nach der Elektronen-Aufnahme. Das Redox-Potential kann wie eine elektrische Spannung gemessen werden und hat deshalb auch deren Einheit: Volt.
Je positiver das Redox-Potential ist eines solchen Teilchenpaares ist, desto lieber wandelt sich der elektronenärmere Partner durch Elektronen-Aufnahme zum elektronenreicheren Partner (d.h. je positiver das Redox-Potential ist, desto lieber wird der elektronenärmere Partner reduziert.
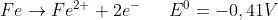
(Das Redox-Potential für die Paarung Fe/Fe2+ ist negativ: Fe2+ wird nur schwerlich reduziert – Fe dafür um so leichter oxidiert).
Das Redox-Potential eines Teilchenpaares lässt sich auch mit guten Kenntnissen des Aufbaus der Atome allenfalls abschätzen. Genaue Werte müssen hingegen gemessen werden. Unglücklicherweise kann man einzelne Redox-Potentiale, also das Streben einer einzelnen Teilchensorte nach Elektronenaufnahme, nicht messen, sondern nur das Bestreben, Elektronen von einem bestimmten Reaktionspartner zu übernehmen.
Aber Chemiker wären nicht Chemiker, wenn sie da nicht einen Ausweg gefunden hätten: Sie haben einfach ein Teilchenpaar bestimmt, dessen Redox-Potential gleich Null sei, nämlich die Paarung von H+-Ionen und Wasserstoffatomen (in Wasserstoffmolekülen, H2, die durch Aufnahme je eines Elektrons pro Atom aus den H+-Ionen entstehen) unter ganz bestimmten Rahmenbedingungen. Dieses Paar kann man in Wirklichkeit nebeneinander stellen, indem man eine reaktionsträge Platin-Elektrode in eine Lösung mit 1 mol/l H+-Ionen taucht und sie mit Wasserstoff-Gas (bei einem Druck von 1 bar) umspült. Eine solche Konstruktion wird Normal-Wasserstoffelektrode genannt.
Und wenn man die mit einer Wirklichkeit gewordenen Paarung anderer Teilchen (zum Beispiel einer Eisenelektrode in einer Lösung von Eisen-Ionen) verbindet und ein Voltmeter dazwischen schaltet, zeigt dieses die Differenz zwischen dem Redox-Potential des Eisen-Paares und jenem der Normal-Wasserstoffelektrode – also die Abweichung des Redox-Potentials des Eisen-Paares von Null.
So lange die Chemiker sich also einig sind, wie eine Normal-Wasserstoffelektrode auszusehen hat und welche Rahmenbedingungen einzuhalten sind (Temperatur, Druck, Konzentration der Ionenlösung..), gilt der gemessene Wert als Redox-Potential des Eisenpaares.
So unter stets gleichen Bedingungen gemessene Werte für verschiedene Teilchenpaare kann man in einer Liste ordnen, die als Spannungs- oder Redox-Reihe bekannt ist.

Spannungsreihe: Einige Teilchen-Paare und ihre Redox- (hier: Standard-)potentiale
In dieser Liste kann man nun ablesen, dass Sauerstoff in Gegenwart von Wasser viel stärker danach strebt Elektronen aufzunehmen und zu OH– zu reagieren, als Fe2+-Ionen zu Eisen-Atomen zu reagieren streben. Die Folge: Eisen rostet bei Wind und Wetter ohne viel Federlesen.
Gold-Ionen (Au3+) würden wiederum sehr viel lieber Elektronen aufnehmen und zu Gold-Atomen reagieren, als Sauerstoff in Gegenwart von Wasser. Die Folge: Gold „rostet“ selbst in Jahrtausenden in feuchter Erde nicht. Das starke Streben nach Elektronenaufnahme überdies dazu, dass Gold-Atome ihre Elektronen auch in Gegenwart der meisten Säuren erst gar nicht an Wasserstoff abgeben. Damit ist Gold auch weitgehend sicher vor Säurekorrosion (so lange man nicht im Labor zu richtig „brutalen“ Mitteln greift)
Ihre Beständigkeit gegenüber Säure- und Sauerstoffkorrosion hat Gold und anderen Metallen, die auch bei Wind und Wetter ihren Glanz auf wundersame Weise mehr oder weniger lange behalten, die Bezeichnung „Edelmetalle“ eingetragen. Metalle, die leicht korrodieren, werden hingegen auch „unedel“ genannt.

Einst wurde hier begehrtes Edelmetall geschürft – jetzt rostet es vor sich hin: Verlassene Goldmine bei Cripple Creek, Colorado, USA CC-BY-SA 4.0 by Reto Lippuner
Warum rostet Eisen am Meer besonders stark?
Auf der Kanaren-Insel Lanzarote hat uns eine Erkundungstour einmal in einen (zukünftigen) Ortsteil in Küstennähe geführt, in welchem die Strassen samt Strassenlaternen, Papierkörben und mehr vor dem Bau der Häuser (mit dem man noch nicht einmal begonnen hatte!) angelegt worden waren. Zu unserem Erstaunen fanden wir die Laternen auf den einsam da liegenden Strassen hochgradig verrostet vor (und haben leider keine Bilder gemacht). Konnte sich der Bau der Häuser tatsächlich schon so lange verzögert haben? Eigentlich wirkten die Strassen selbst doch ziemlich neu…da musste das Eisen irgendwie schneller als gewöhnlich gerostet sein – und zwar aus folgendem Grund:

Nicht auf Lanzarote, dafür auf Teneriffa zeigt diese Sonnenuhr trotz Rost die Zeit CC-BY-SA 4.0 by Reto Lippuner
Die beiden Teilreaktionen zum Austausch von Elektronen zwischen Eisen und Sauerstoff finden während der Rost-Entstehung an verschiedenen Orten statt. Beide Reaktionen können daher nur dann dauerhaft ablaufen, wenn genügend Ladungen zwischen diesen Orten hin- und her geschafft werden können. Und für einen reibungslosen Ladungstransport wird ein möglichst guter elektrischer Leiter benötigt.
Bei der Rost-Entstehung bildet der Wassertropfen diesen Leiter (ein flüssiger elektrischer Leiter wird auch Elektrolyt genannt): Reines Wasser enthält immer auch einige wenige H3O+– und OH–-Ionen, die zwecks Ladungstransport bewegt werden können. Sind im Wasser aber zusätzliche Ionen enthalten – zum Beispiel weil Meersalz darin gelöst ist ( ), dann leitet es den Strom um ein Vielfaches besser, sodass der Elektronenaustausch bei der Rost-Entstehung viel schneller bewerkstelligt werden kann!
), dann leitet es den Strom um ein Vielfaches besser, sodass der Elektronenaustausch bei der Rost-Entstehung viel schneller bewerkstelligt werden kann!
Deshalb ist nicht nur die Anlage von Geister-Strassen an der Küste und ohne besonderen Rostschutz unklug. Auch wer mit eisernen Schiffen zur See fährt, sollte sich regelmässig und gründlich um Rostschutz bemühen, möchte er nicht irgendwann mit Mann und Maus untergehen.

Ausgemustert oder zwecks (Rost-)Reparatur auf dem Trockendock? Bohrplattformen im Hafen von Santa Cruz de Tenerife CC-BY-SA 4.0 by Reto Lippuner
Aber wie kann man Eisen vor dem Rosten schützen?
Wie man ein Metall vor dem Angriff durch Sauerstoff und Wasser schützt? Indem man diesen beiden Übeltätern etwas in den Weg stellt! Das lässt sich beim Eisen auf mehreren Wegen erreichen:

Stop Korrosion! Rost-Polizei an der Route 66, Arizona, USA CC-BY-SA 4.0 by Reto Lippuner
1. Man verarbeitet das Eisen zu „rostfreiem“ Stahl – einer Legierung (ein Mischmetall aus verschiedenen Metallatomen) von Eisen mit mindestens 10,5% Chrom und weiteren Bestandteilen in kleinen Mengen. Das Chrom bildet eine luft- und wasserdichte „Passivschicht“ aus Chromoxid an seiner Oberfläche und schützt damit auch die Eisenatome in seiner Nachbarschaft. Der Nachteil: Solche Stähle sind zäher als Eisen, was das Bohren darin erschwert und dazu führt, dass Gewinde von Schrauben sich schneller festfressen.

Kein Chromstahl: Rostender Stahlträger aus dem alten World Trade Center vor dem Neubau – 9/11-Denkmal auf Staten Island, New York City, USA CC-BY-SA 4.0 by Reto Lippuner
2. Man streicht Eisenteile mit möglichst witterungsbeständigen Farben oder Lacken. Da kommen Wasser und Sauerstoff im Idealfall nicht durch. Allerdings gibt praktisch jede Farbschicht dem Trommelfeuer von Sonnenstrahlung, Wind und Nässe früher oder später nach und blättert ab. Und wenn man dann nicht sofort nachstreicht, rostet das Eisen eben doch.

Dem Wilden Westen ist kein Lack gewachsen (gefunden auf Antelope Island im Great Salt Lake, Utah, USA) CC-BY-SA 4.0 by Reto Lippuner
Wesentlich beständiger als ein Anstrich mit Lack und Farbe ist eine Beschichtung des Eisens mit einem anderen Metall. Bewerkstelligen lässt sich das, indem man das Metall mittels Elektrolyse auf dem Eisen abscheidet, oder indem man das Eisen komplett in das geschmolzene Metall eintaucht. Die beiden Metallschichten „verzahnen“ sich dabei an ihrem Übergang praktisch Atom für Atom, was sie nahezu untrennbar miteinander verbindet.
3. Auf den ersten Blick scheinen für eine solche Beschichtung „edlere“, also korrosionsbeständige Metalle Wunschkandidaten zu sein. Das dachten sich auch die Hersteller von Dosen aus Weissblech, also aus mit einer Zinn-Schicht versehenem Eisen.
Die Korrosionsbeständigkeit kann jedoch ebenso gut zum Problem werden, beruht sie doch darauf, dass „edlere“ Metalle noch lieber Elektronen aufnehmen als Eisen. Sobald die Zinn-Schicht einer Weissblech-Dose nämlich beschädigt wird, sodass das Eisen Fe2+-Ionen an Wasser in seiner Umgebung abgeben kann, sorgt das verbleibende Zinn in der Nachbarschaft des Schadens dafür, dass die zurückbleibenden Elektronen sich gar nicht erst im Eisen ansammeln können, sondern umgehend zur Reduktion weitergeleitet werden. So rostet beschädigtes Weissblech letztlich noch schneller als ungeschütztes Eisen.

Auch Chrom ist edler als Eisen: Wo die Chromschicht leckt, rostet es besonders schnell (an der Route 66, Arizona, USA) CC-BY-SA 4.0 by Reto Lippuner
4. Das Problem mit den edleren Metallen kann man sich jedoch ebenso gut zunutze machen – indem man nämlich das Eisen mit einem unedleren Metall beschichtet, zum Beispiel mit dem sehr beliebten Zink. Wind und Wetter ausgesetzt bildet Zink an seiner Oberfläche rasch eine passive Schicht, die es zunächst vor der weiteren Korrosion bewahrt. Kommt aber ein verzinktes Eisenwerkstück zu Schaden, übernimmt das freigelegte Eisen die Rolle des edleren Metalls: Es begünstigt die Korrosion des Zinks ohne selbst Schaden zu nehmen. Das verschafft Verantwortlichen Zeit um den Schaden zu beheben ehe Rost entstehen kann.
5. Eine noch extremere Variante von Methode Nummer 4 kommt zum Beispiel bei unterirdischen Eisen-Tanks zum Einsatz: Dort wird ein Block aus einem sehr unedlen Metall über eine Leitung mit dem Tank verbunden und…schlichtweg der Korrosion überlassen. Denn während eine solche „Opferanode“, beispielsweise aus Magnesium, langsam oxidiert wird, liefert sie Elektronen, die an der Eisenoberfläche zur Reduktion eingesetzt werden können – ohne dass Eisenionen ins Spiel kommen und somit Rost entsteht. Es empfiehlt sich daher, solche Opferanoden regelmässig zu ersetzen, ehe sie gänzlich oxidiert sind. Oder man schliesst den Eisentank an den (physikalischen) Minuspol einer Gleichstromquelle (Batterie) an, deren Pluspol mit einer Graphitelektrode verbunden ist. So lange die Batterie hält, liefert dann sie anstelle des Eisens die Elektronen für die Reduktion.
Und was tun, wenn schon Rost entstanden ist?

Rost liebevoll kultiviert: Dächer in der Geisterstadt Bodie (wird als Freilichtmuseum gefplegt) in der Sierra Nevada, Californien, USA CC-BY-SA 4.0 by Reto Lippuner
Da Rost in der Regel durchlässig daher kommt und nicht wenig Wasser enthält, solltest du entstandenen Rost in jedem Fall entfernen, ehe du zu weiteren Rostschutzmassnahmen schreitest. Am einfachsten schleifst du ihn schlichtweg ab – mit einer passenden Schleifmaschine oder einem Sandstrahler.
Wenn das allerdings zu mühsam ist, oder eine bestehende Schutzschicht dadurch weiter beschädigt werden könnte, kannst du kleineren Roststellen stattdessen mit einem „Rostumwandler“ zu Leibe rücken, zum Beispiel mit verdünnter Phosphorsäure (H3PO4). Die reagiert nämlich mit den Sauerstoff-Verbindungen von Fe3+-Ionen im Rost zu Eisen(III)phosphat, FePO4, welches anders als Rost fest und undurchlässig ist und überdies mit seiner stumpfgrauen Farbe nicht so auffällt.
Phosphorsäure ist übrigens auch nicht zu knapp in Cola anzutreffen, weshalb das Getränk unter Liebhabern älterer Fahrzeuge auch schonmal als Rostumwandler zweckentfremdet wird. Phosphorsäurelösung in etwas höherer Konzentration ist im Zweifelsfall jedoch merklich wirksamer.
Beiden Methoden gemeinsam ist allerdings der Haken: Das einmal zu Rost reagierte Eisen ist unrettbar verloren. Beim Abschleifen wird es einfach vom Werkstück entfernt, während es durch Rostumwandler in eine andere Verbindung eingebaut wird, die zwar beständiger als Rost, aber ebenfalls ein Salz ist, das gänzlich andere Eigenschaften hat als ein Metall.

Definitiv zu spät für Rostschutzmassnahmen: Echte Rostlaube (das Auto, nicht ich!) in der Geisterstadt Bodie, Californien, USA CC-BY-SA 4.0 by Reto Lippuner
Ich empfehle in Sache Rost also Vorsorge statt Nachsorge : Gönne deinem Eisen einen guten Rostschutz, bevor sich Rost bilden kann – und wenn doch etwas rostet, sorge rasch dafür, dass dem Einhalt geboten wird. Es sei denn, du möchtest auch an der Rostparade teilnehmen, die am Ende jedes Monats von Frau Tonari ausgerufen wird, und benötigst dazu noch ein Fotomotiv!
Und was ist Rost für dich? Lästiger Übeltäter oder farbige Oberflächenverschönerung?
































