Auf der Grillparty mit Reto, Lilli, Andi und Dominik sind wir im ersten Teil dieses Artikel-Duos schon fünf chemischen Reaktionen begegnet, die in allen Bereichen der Chemie grundlegend und im Alltag häufig zu finden sind.
In der Organischen Chemie, der Chemie der Kohlenwasserstoff-Verbindungen, gibt es drei weitere wichtige Reaktionstypen. Diese finden sich im Alltag häufig dann wieder, wenn es um Biochemie geht. Denn die Biochemie, die Chemie des Lebens, dreht sich notgedrungen um Kohlenwasserstoff-Verbindungen, sind doch alle irdischen Lebewesen massgeblich daraus aufgebaut.
Drei grundlegende Reaktionen in der Organischen Chemie – und warum auf unserer Grillparty niemand vergiftet wird
Dass es auf unserer Grillparty sehr lebendig zugeht, steht ausser Frage. So wundert es nicht, dass sich auch folgende drei Reaktionstypen dort wiederfinden. Nunja, zum Glück finden nur zwei davon wirklich statt, denn die Reaktion des letzten Typs hätte ziemlich unangenehme Folgen.
1. Die Eliminierung: Warum Gegrilltes so lecker schmeckt – und Lilli trotzdem nörgelt
Steaks und Würstchen brutzeln auf dem Rost, werden braun und knusprig und es duftet verlockend nach Gebratenem. Neue Eigenschaften, neue Stoffe? Da ist eindeutig eine chemische Reaktion im Gange. Sogar eine ganze Menge chemischer Reaktionen. Eiweisse im Fleisch reagieren mit Fett und Zucker und was ein guter Koch sonst noch alles in seine Marinade packt.
In vielen Reaktionen, die teils aufeinander folgen, entstehen so neue Stoffe, die knusprig aussehen, lecker schmecken und gut duften. All diese Vorgänge miteinander werden von den Chemikern „Maillard-Reaktion“ genannt. Die zahllosen Wege der Maillard-Reaktion haben eines gemeinsam: Am Anfang werden stets zwei grössere Moleküle, z.B. Traubenzucker (Glucose) und die Aminosäure Asparagin, aneinander geheftet, wonach drei Atome nicht länger gebraucht werden und ein kleines Wassermolekül, H2O, bilden. Das Wassermolekül wird also im Zuge der Reaktion von den Ausgangsstoffen entfernt (eliminiert). Bei einer Eliminierung wird ein kleines Molekül aus dem Reaktionsgeschehen entfernt.
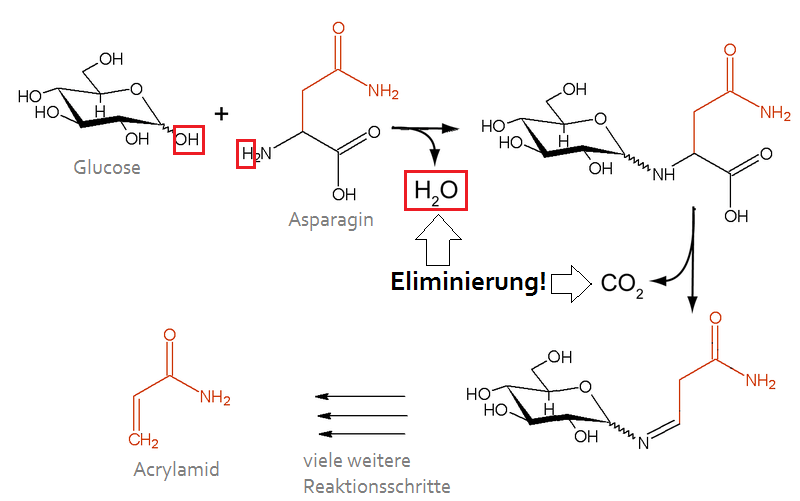
Maillard-Reaktion: Im ersten Reaktionsschritt wird ein Wassermolekül eliminiert. Auch der zweite Schritt ist eine Eliminierung: Dabei bleibt statt Wasser ein Kohlendioxid-Molekül übrig. Acrylamid ist allerdings nur ein unerwünschtes unter vielen erwünschten Endprodukten.
Wenn man zu heiss brät (ab etwa 180°C), kann bei der Maillard-Reaktion übrigens das als krebserzeugend verschriene Acrylamid entstehen. Lilli gefällt diese Aussicht gar nicht, aber uns soll es den Appetit heute nicht verderben. Schliesslich bemühen wir uns ja darum, dass der Grill nicht gar zu heiss wird..
Und Appetit hat inzwischen sogar Reto, der sein Sodbrennen dank seiner Notfalltabletten gut im Griff hat. Schliesslich grillen wir ja nicht nur zum Spass, sondern haben auch einen Nutzen davon, Acrylamid hin oder her.
2. Die Addition: Die Verdauung unter die Lupe genommen
Grillfleisch ist nämlich nicht nur lecker, sondern auch nahrhaft. Es enthält reichlich Eiweisse (die Biochemiker sagen Proteine), die aus Aminosäuren aufgebaut sind. Und die verwendet unser Körper zum Aufbau eigener Eiweisse wieder.
Um an diese Aminosäuren heranzukommen müssen die Bindungen, welche sie im Eiweiss zusammenhalten, aufgehoben werden. Dies geschieht, indem ein Eiweiss-Molekül an den Bindungen zwischen den Aminosäuren (den „Peptidbindungen“) mit Wassermolekülen reagiert: Die Peptidbindung wird durchtrennt und die Atome des Wassermoleküls an die losen Enden angefügt. Bei einer Addition wird ein kleines Molekül an mindestens ein grösseres Molekül angefügt.
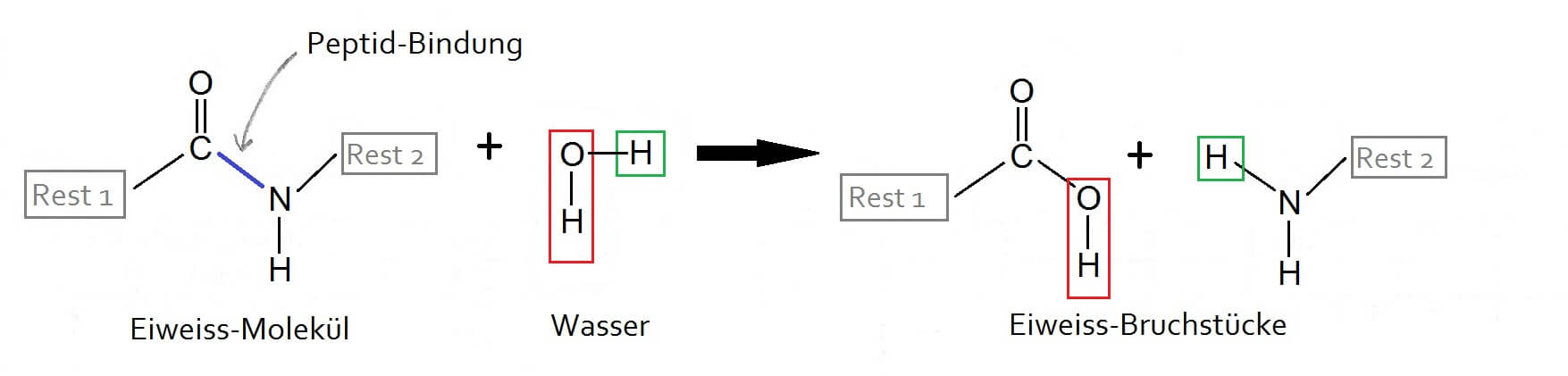
Addtition von Wasser an eine Peptidbindung: Eiweisse (Proteine) bestehen aus langen Ketten von Aminosäuren, die durch Peptidbindungen zusammengehalten werden. Rest 1 und Rest 2 stehen für die Kettenabschnitte beiderseits der dargestellten Peptidbindung.
Und weil die Addition von Wasser an Peptidbindungen bei Körpertemperatur nicht recht in Gang kommt, gibt es im Magensaft das Verdauungsenzym Pepsin, das Eiweisse und Wassermoleküle auf den rechten Weg zur Reaktion bringt. Aber das ist eine andere Geschichte.
Übrigens, wenn du es schon vermutet hast: Die Addition ist tatsächlich die Umkehrreaktion der Eliminierung: Bei der Bildung von Peptid-Bindungen wird genau dort ein Wassermolekül eliminiert, wo es bei der Zerlegung der Eiweisse wieder addiert wird.
3. Die Substitution: Warum Dominik den Giftnotruf nicht wählen musste
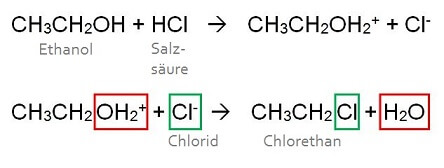
Gut gesättigt und ein kühles Bier in der einen Hand surft Dominik mit dem Handy in der anderen Hand durchs Web. Plötzlich stutzt er und stellt erschrocken seine Bierflasche ab. Da wird in verschiedenen Foren behauptet, unser Trinkalkohol, den Chemikern als Ethanol (CH3CH2OH) bekannt, könne mit der Magensäure zu Chlorethan, einem hochentzündlichen Gas und Nervengift, reagieren!
Tatsächlich steht in meinem Lehrbuch für organische Chemie [1] eine Gruppe von Reaktionspaaren, zu der auch diese beiden gehören:
Hat eine Säure dem Ethanol-Molekül erst ein Proton übergeben, kann das so entstandene „angehängte“ Wassermolekül gegen ein Chlorid-Ion ausgetauscht werden. Damit ist die zweite Reaktion eine Substitution. Bei einer Substitution wird eine Atomgruppe eines grösseren Moleküls gegen eine andere ausgetauscht.
Für die von Dominik entdeckte Substitution braucht es laut dem Lehrbuch einzig eine Säure im Reaktionsgemisch, die den Ethanol-Molekülen eine austauschbare Atomgruppe verschafft. Tatsächlich kann die Salzsäure im Magensaft den Ethanol protonieren (das entstehende CH3CH2OH2+ macht eifrigen Trinkern häufig Magenschmerzen), und stellt auch noch Chlorid-Ionen zur Verfügung…
Trotzdem kann ich Dominik beruhigen. Damit die Substitution (hier handelt es sich um eine sogenannte nukleophile Substitution) stattfinden kann, muss das Chlorid das Zielmolekül – bzw. den Atomkern, an den es binden soll – auch genügend mögen (es muss nukleophil = kernmögend sein). Und Chlorid-Ionen sind nicht eben allzu versessen auf protonierten Ethanol.
Das rührt zum Einen daher, dass das Ethanol-Molekül, mit oder ohne Extra-Proton, ziemlich unattraktiv für den Teilchen-Austausch ist. Zum anderen sind nukleophile Teilchen umso kernmögender, je schwächer sie basisch reagieren. Und der Rest (bzw. das Anion) einer starken Säure ist zwar stets eine schwache Base, doch ist die Salzsäure im Magensaft für Dominiks Reaktion nicht stark genug (und die Base Chlorid entsprechend nicht schwach genug).
Daher braucht es eine wesentlich stärkere Säure als Salzsäure, um aus protoniertem Alkohol durch eine Substitution Chlorethan zu machen. Im Labor kann man solch eine Säure herstellen, indem man reichlich Zinkchlorid in konzentrierte Salzsäure gibt:
Mit der so entstehenden Tetrachlorozinksäure kann man im Labor mit etwas Geschick Chlorethan aus Ethanol gewinnen. Aber nicht allein mit der verdünnten Salzsäure in unserem Magensaft.
Wir können das Handy also wegstecken, die Giftnotrufnummer (in der Schweiz lautet die übrigens 143) für heute vergessen und die Grillparty mitsamt dem kühlen Bier geniessen. Und da du nach der Lektüre von Teil 1 und Teil 2 nun die wichtigsten Typen der chemischen Reaktion sowohl für die allgemeine als auch für die organische Chemie kennst, kannst du etwas Ordnung in die Vielfalt der alltäglichen Reaktionen bringen.
Welche chemische Reaktion ist dir in deinem Alltag schon begegnet?
[1] Beyer, H., Walter, W. (1998). Lehrbuch der organischen Chemie (23. Auflage). Stuttgart; Leipzig: Hirzel