Zeolithe sind nicht nur im Haushalt äusserst nützlich. Auch als Nahrungsergänzungsmittel für Entgiftungskuren ist „Zeolith“ überaus populär. Da diese Anwendung dieser vielseitigen Stoffgruppe hier aber den Rahmen sprengen würde, kommt ein zweiter Artikel zu Zeolithen und Detox nächste Woche!
Was ist eigentlich in unserem Waschpulver drin? Diese Frage kam neulich beim Nachtessen mit der Schwiegermutter auf. Na klar: Seife. Oder in der Chemiker-Sprache: Tenside. Und über deren Super-Waschkraft habe ich hier ja schon geschrieben. Aber nachsehen schadet ja nichts, dachte ich. Und siehe da: Mein Universal-Waschpulver vom orangen M enthält nur 5-20% Tenside – und 15%-30% Zeolithe. Was ist das denn nun schon wieder?
Was sind Zeolithe?
Laut Definition im Chemiebuch oder auf Wikipedia sind Zeolithe eine Gruppe von „kristallinen Alumosilikaten“… mit anderen Worten: Steine. Und zwar Steine, welche die chemischen Elemente Silizium und Aluminium enthalten. Das ist an sich nichts besonders, sind Silizium und Aluminium doch das zweit- und dritthäufigste Element in der Erdkruste.

Das Ionengitter der Zeolith-Kristalle, aus welchen diese Steine bestehen, ist allerdings ein ganz besonderes: Es enthält grosse Lücken, die den ganzen Kristall zu einem porösen Schwamm machen!
Wie sind Zeolith-Kristalle aufgebaut?
Die allgemeine Verhältnisformel der Zeolithe lautet:
Mn+x/n [(AlO2)−x (SiO2)y] . z H2O
Ein Schweizer Käse aus Si- und Al-Atomen
Der Inhalt der eckigen Klammer beschreibt das eigentliche Kristallgitter: Es besteht aus Silizium (Si)-, Aluminium (Al)- und Sauerstoff (O)-Atomen, wobei auf x Silizium-Atome stets y Aluminium-Atome kommen. Jedes dieser Atome ist mit vier Sauerstoffatomen verbunden (die wiederum werden dazu je zweimal verwendet, weshalb die Formel nur 2 Sauerstoff-Atome je Metallatom enthält). Anders eingeteilt besteht das Zeolith-Gitter somit einander überlappenden Sauerstoff-Tetraedern mit je einem Silizium- oder Aluminiumatom im Zentrum.
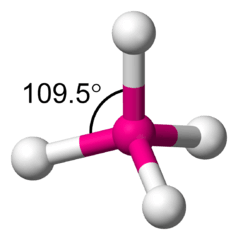
Molekülmodell in Form eines Tetraeders: Die vier weissen Kugeln befinden sich in den vier Ecken dieses geometrischen Körpers, die pinke Kugel liegt in dessen Zentrum.
Wer sich ein etwas mit organischer Chemie auskennt (da sind es Kohlenstoff-Atome, die mit ihren Nachbarn Tetraeder bilden), weiss, dass man aus Tetraedern die vielfältigsten Gerüste bauen kann. Deshalb gibt es ein wahres Sammelsurium von Zeolithen:
60 natürlich vorkommende Mineralien gehören zu dieser Gruppe, über 150 weitere sind von Chemikern entworfen und künstlich hergestellt worden!
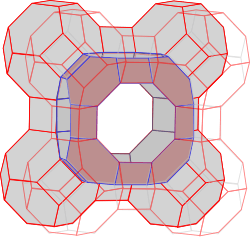
Sie alle haben eines gemeinsam: Ihre Gitter umfassen mehr oder weniger grosse Hohlräume – ein richtiger molekularer Schweizer Käse. In Waschmitteln findet man vor allem der synthetische Zeolith A, dessen Kristallgitter so aussieht:
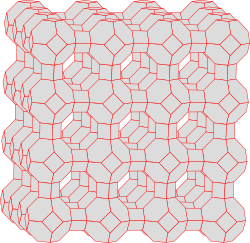
Jede Ecke in der Skizze steht für ein Silizium- oder Aluminium-Atom. Die Sauerstoff-Atome sind dazwischen entlang der Verbindungslinien angeordnet.
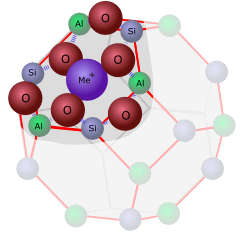
In der Mitte zwischen acht dieser Einheiten bleibt ein relativ grosses Loch, dessen Wände die Chemiker als alpha-Käfig“ bezeichnen.
Im Zeolith A sind ebenso viele Silizium- wie Aluminium-Atome enthalten – die Verhältnisformel für diesen Zeolith lautet damit:
Na12((AlO2)12(SiO2)12) · 27 H2O
Zeolith-Kristalle sind Riesen-Anionen
Wenn ihr euch die allgemeine Verhältnisformel der Zeolithe oder die für Zeolith A genauer angesehen habt, ist euch vielleicht das „-“ an der Aluminium-Einheit aufgefallen. Richtig: Jeder Aluminium-Tetraeder im Gitter trägt eine negative elektrische Ladung. Damit ist das ganze Kristallgitter eines Zeoliths ein einziges riesiges und tausendfach geladenes Anion!
So etwas lässt die Natur aber nicht einfach frei und einsam existieren…entgegengesetze Ladungen müssen für den Ausgleich her. Hier kommen die positiven Metall-Ionen Mn+, die ganz links in der Verhältnisformel stehen, ins Spiel. Für jede negativ geladene Aluminium-Einheit muss ein einfach positiv geladenes (n = 1) Metall-Ion her. Wenn mehrfach positiv geladene (n > 1) Metall-Ionen zur Hand sind, ist die Anzahl x der Aluminium-Einheiten durch die Ladungszahl der Metall-Kationen zu teilen (x/n).
Zeolith A enthält einfach geladene Na+-Ionen – 12 davon für 12 Aluminium-Einheiten, die in den Lücken im Gitter Platz finden und sich locker um das negativ geladene Gerüst herum anordnen.
Zeolithe sind molekulare Schwämme
Ausserdem ist in den Lücken noch reichlich Platz für Wassermoleküle. Die finden sich ganz rechts in der Verhältnisformel wieder. Die Wassermoleküle umhüllen sowohl die Metall-Kationen als auch das Gitter selbst, was den Metallionen den Aufenthalt im Gitter erst richtig gemütlich macht (eine Wasserhülle (in Chemikersprache: „Hydrathülle“) um ein wasserlösliches Ion enthält weniger Energie als das Ion ohne Hülle, was den umhüllten Zustand erstrebenswerter macht).
Durch Erhitzen können diese Wassermoleküle jedoch zum Verdampfen gebracht werden und den Kristall verlassen. Das ist eine charakteristische Eigenschaft von sogenanntem „Kristallwasser“, das einer chemischen Formel mit einem „*“ bzw. Multiplikations-Punkt angehängt wird.
Auf eine Grundeinheit des Zeolith-A-Gitters kommen so normalerweise 27 Wassermoleküle.
Was hat die grosse Menge Zeolith A in Waschmitteln zu suchen?
Zeolithe können Wasser enthärten!
Die Hohlräume der Kristalle der Zeolithe enthalten von Wasser umhüllte Natrium-Ionen. Diese Ionen sind damit regelrecht im Kristallwasser gelöst. Das macht sie leicht darin beweglich. Tatsächlich können sie sich durch den ganzen Kristall und hinaus bewegen. Wenn sich nun andere Metall-Ionen finden, die es in einem Zeolith-Kristall noch behaglicher finden, können die Natrium-Ionen deshalb ganz leicht gegen solche ausgetauscht werden.
Und in unserem Leitungswasser, mit welchem wir unsere Wäsche waschen, finden sich solche Ionen zuhauf. Es ist schliesslich mehr oder weniger „hart“ – es enthält Kalk: Calciumcarbonat, genauer gesagt Calcium- (Ca2+) und Carbonat- (CO32-) Ionen.
[Für die Chemiker unter euch: Carbonat CO32- ist natürlich eine Base und reagiert mit Wasser zu Hydrogencarbonat- (HCO3–) und Hydroxid-Ionen (OH–) weiter, anstatt einfach gelöst zu werden. Aber das ist hier für einmal nicht von Bedeutung.]
Zusammen bilden diese beiden die gefürchteten Kalkbeläge, welche die Leitungen in unseren Waschmaschinen verstopfen und die Wäsche steif machen können. So etwas will keiner haben.
Wenn Zeolithe im Waschwasser sind, machen es sich die Calcium-Ionen jedoch lieber in den Hohlräumen des Zeolith-Gitters gemütlich und verdrängen dabei die Natrium-Ionen aus dem Zeolith A. Einen vollständigen Austausch von Natrium- gegen Calcium-Ionen könnte man so beschreiben:
Na12((AlO2)12(SiO2)12) · 27 H2O + 6 Ca2+(aq) –> Ca6((AlO2)12(SiO2)12) · 27 H2O + 12 Na+(aq)
Nachdem die Calciumionen sich im Zeolith eingerichtet haben, bleiben im Wasser Natrium- und Carbonat-Ionen zurück. Und Natriumcarbonat (auch als „Soda“ bekannt) ist sehr gut wasserlöslich. So lagert es sich weder in der Maschine noch in der Wäsche ab und kann einfach fortgespült werden.
Das Gleiche geschieht mit dem Zeolith-Pulver. Das ist zwar nicht wasserlöslich, aber so fein gemahlen, dass es einfach mit weggeschwemmt wird.
Womit hat man früher Wasser enthärtet?
Künstliche Zeolithe wie Zeolith A kommen erst seit den späten 1970er Jahren in Waschmitteln zum Einsatz. Davor haben Gerüste aus Phosphor und Sauerstoff – also Phosphate – diese Aufgabe übernommen. Die Phosphat-Gerüste neigen allerdings dazu zu zerfallen, was sie zu ergiebigen Nährstoffen für Pflanzen macht.
Als solche Phosphate vermehrt mit Abwässern in die Umwelt gelangten, wurde das rasch zum Problem: Die Nährstoff-Schwemme führte zu Überdüngung und brachte viele ökologische Systeme aus dem Gleichgewicht. So wurden die Phosphate zunehmend durch Zeolithe ersetzt. Denn letztere sind schliesslich Steine – die taugen nicht als (unnötiger) Dünger.
Einen Haken haben Steine aber dennoch: Sie sind wasserunlöslich. Damit gelangt das ganze Zeolith-Pulver unverändert mit dem Abwasser in die Kläranlagen…und was gibt pulverisiertes Gestein in Wasser? Richtig: Schlamm. Und der sammelt sich in den Klärbecken. Seit Zeolithe in Waschmitteln zum Einsatz kommen, müssen Klärwerke deshalb mit merklich mehr Klärschlamm fertig werden – Grund genug, auch phosphatfreie (und zeolithhaltige) Waschmittel nicht in übertriebenen Mengen einzusetzen.
Zeolithe als Helferlein im Katzenklo
Habt ihr Katzen daheim? Dann kennt ihr Zeolithe wahrscheinlich auch von anderswo. Nämlich aus dem Zoohandel. Da wird nämlich gerne ein Naturzeolith (also ein natürlich vorkommendes Mineral) namens Klinoptilolith als Katzenstreu angeboten.
Die porösen Kristallgitter lassen sich nämlich nicht nur als Ionenaustauscher nutzen, sondern auch wie ein richtiger Schwamm! Das geht dann besonders gut, wenn der Zeolith etwa ebenso viele Silizium- wie Aluminiumatome enthält. Das synthetische Zeolith A ist ein gutes Beispiel dafür: Hier ist das Verhältnis zwischen Silizium und Aluminium 1:1. Aber auch Klinoptilolith mit 5:1 ist noch ein wunderbarer Schwamm.
Diese Zeolithe sind nämlich wahnsinnig heiss darauf, ihre Poren mit zusätzlichem Wasser aus ihrer Umgebung zu füllen (buchstäblich: Da es das Wasser in den Poren so bequem hat, wird eine Menge Energie, genannt „Adsorptionswärme“, dabei frei.
Doch damit nicht genug: Mit dem Wasser saugen sie auch vieles auf, was darin gelöst ist. Zum Beispiel Geruchsstoffe im Katzenurin. So werden die Nasen der menschlichen Dosenöffner geschont, während die Katze ihr Geschäft in natürlichem Gesteinsschutt verscharren kann.
Von Zeolith-Katzenstreu zu Pflanzenerde
Natürlicher Gesteinsschutt, der Wasser und überdies noch Nährstoffe (Urin, auch von Katzen, enthält naturgemäss Stickstoffverbindungen) speichert, kann zudem als Bestandteil von Pflanzenerde nützlich sein (andere formstabile Wasserspeicher sind „Superabsorber“ aus organischen Polymeren („Kunststoffen“), die ich in diesem Experiment als Ersatz für Pflanzenerde verwendet habe). Deshalb gilt Katzenstreu aus Naturzeolithen als geeignet für den Kompost.
Eigentlich sollte für synthetische Zeolithe dasselbe gelten – es handelt sich dabei schliesslich um Designer-Steine. Aber „natürlich“ hat nunmal die weitaus grössere Werbewirkung – und ist in diesem Fall überdies billiger. Naturzeolithe kommen nämlich nahe der Erdoberfläche vor und können im Tagebau gewonnen werden (mit allen Konsequenzen für die Landschaft). Das künstliche Nachstellen der Entstehung von Steinen – so werden synthetische Zeolithe gemacht – ist hingegen ziemlich aufwändig. Mehr zum Vergleich von natürlichen und synthetischen Zeolithen findet ihr hier.
Zeolith im Geschirrspüler
Die „Saugfähigkeit“ von Zeolithen wird seit einigen Jahren auch in der Küche genutzt. Hier kommt eine fest eingebaute Schale mit Zeolith-Pellets in der Spülmaschine zum Einsatz. Und zwar zur energiesparenden Trocknung.
Die Idee dahinter: Nach dem Spülgang ist das Maschineninnere samt Geschirr und Luft noch nass. Ein Ventilator bläst diese feuchte Luft durch den Behälter mit dem Zeolith, welcher das Wasser „aufsaugt“ und dabei eine grosse Menge (Adsorptions-)Wärme abgibt. Die Luft kommt also trocken und warm in den Geschirrspüler zurück und bringt dort weiteres Wasser zum Verdampfen, das anschliessend vom Zeolith aufgenommen werden kann.
Beim nächsten Spülgang wird dagegen der Zeolith geheizt, sodass das Wasser aus den Poren im Kristallgitter verdampft und in den Geschirrspüler zurückgeführt werden kann. So wird der Zeolith für die nächste Trocknung wieder einsatzbereit gemacht.
Das Ganze gilt als sehr energieeffizient – allerdings liest man im Netzt viele Berichte über Geschirrspüler Zeolith-Trocknung (zum Beispiel hier und hier), die bereits nach drei bis fünf Jahren reif für eine unwirtschaftlich teure Reparatur sind. Ob diese Berichte repräsentativ sind, kann ich natürlich nicht sagen – aber es scheint, als wäre diese Technologie noch ausbaufähig.
Schaden oder nützen Zeolithe der Gesundheit?
Mehr dazu gibt es nächste Woche im zweiten Teil über Zeolith für Detox-Kuren!
Und wo sind euch Zeolith bzw. Zeolithe bislang begegnet?