‚Plastik‘ ist „böse Chemie“, die aus Erdöl hergestellt wird und in der Natur nicht verrottet? Mitnichten! Wie ihr schon im Kunststoff-1×1 hier in Keinsteins Kiste nachlesen könnt, ist die Sorte Moleküle, aus denen ‚Plastik‘ besteht, eigentlich eine Erfindung der Natur! Und was die Natur erfindet, kann sie auf kurz oder lang auch wieder abbauen. Das gilt auch für ihre hauseigenen Polymeren – der Stoffgruppe, zu welchen auch die Kunststoffe gehören.
Und diese sogenannten Biopolymere könnt ihr nutzen, um euer eigenes Bioplastik herzustellen – zum Beispiel für ein echt herziges Valentinsgeschenk aus dem eigenen Forscherlabor. Hier erfahrt ihr, wie es geht!
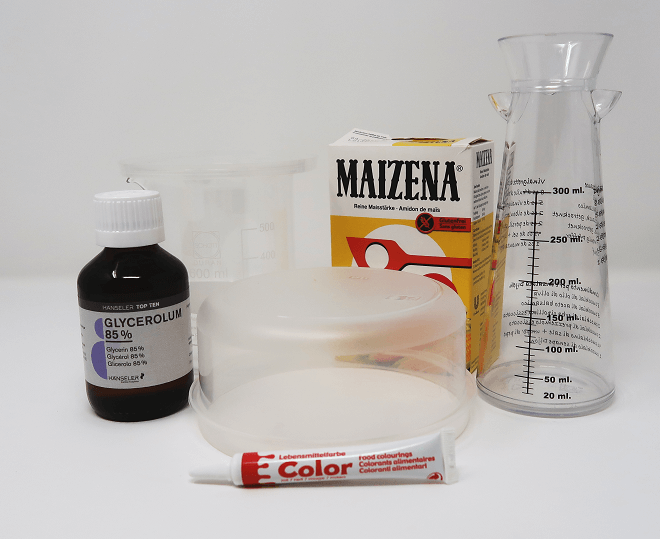
Ihr braucht dazu
Meine Valentins-Herzen bestehen aus Stärkefolie. Wie der Name vermuten lässt, braucht ihr dafür Stärke – und zwar natürliche Stärke, nicht die lösliche Stärke aus dem Laborbedarf oder der Chemiesammlung in der Schule. Natürliche Stärke bekommt ihr auch viel einfacher, nämlich im Supermarkt. In der Schweiz ist „Maizena“ praktisch ein Synonym für Maisstärke, in Deutschland kennt man selbige unter dem Markennamen „Mondamin“. Kartoffelstärke soll aber ebenso funktionieren.
Nun aber zur Inhaltsliste für zwei bis fünf untertassengrosse Folienstücke
- Etwa 5g trockene Stärke (hier in der Schweiz habe ich natürlich Maizena zur Hand)
- Wasser
- Glycerin (85%, aus der Drogerie oder Apotheke)
- Optional: Lebensmittelfarbe
- 1 Becherglas oder ähnliches Glasgefäss
- Topf mit Wasserbad, Herd, Topfhandschuh oder/und Grillzange
- Löffel oder Stab zum Umrühren, Buttermesser
- Frischhaltedosen aus PE oder PP (Polyethylen bzw. Polypropylen, das übliche Material für „Tupper“-Dosen)
- Optional: Backblech, Backofen
So geht’s
- Verdünnt einige Milliliter Glycerin mit der gleichen Menge Wasser und rührt das Gemisch um, bis es klar ist. Diese Glyzerinlösung könnt ihr auch problemlos in einer geschlossenen Flasche für spätere Experimente aufbewahren.
- Gebt zu 5g Stärke im Glasgefäss etwa 40 ml Wasser und etwa 5 ml der zuvor angefertigten Glycerinlösung und rührt gründlich um. Es entsteht ein milchiges Gemisch, aus dem sich Stärke als weisser Schlamm am Boden absetzt, sobald ihr zu Rühren aufhört. Für farbige Herzen könnt ihr zudem einige Tropfen Lebensmittelfarbe einrühren.

- Stellt die Frischhaltedosen mit dem Boden nach oben auf das Backblech oder eine andere Unterlage.
- Stellt den Topf mit dem Wasserbad auf den Herd und erhitzt das Glasgefäss mit dem Gemisch darin, während ihr immer wieder umrührt. Topfhandschuh oder/und Grillzange werden euch beim Festhalten des heissen Glases gute Dienste leisten!
- Sobald die Flüssigkeit zu einer trüben, gelartigen Masse „bindet“ (wie eine Sauce), giesst sie auf die umgekehrten Frischhaltedosen und verstreicht sie mit dem Buttermesser gleichmässig mindestens 2 Millimeter dick. Bei dieser Dicke dauert das Trocknen länger, aber die Gefahr, dass dabei Risse entstehen, ist geringer.

- Lasst die verstrichene Masse über Nacht an der Luft trocknen. Wenn ihr ungeduldig seid, könnt ihr sie zunächst auch bei 50-80°C (wenn ihr Lebensmittelfarbe verwendet NICHT wärmer, da die Farbstoffe sich sonst zersetzen!) eine Stunde oder länger im Backofen trocknen. Dabei besteht allerdings die Gefahr, dass Risse in den Folien entstehen.

- Wenn die Stärkemasse ausgehärtet ist, könnt ihr die Folie (ggfs. mit Hilfe eines flachen Messers) von den Dosen lösen und nach Wunsch zuschneiden.

Achtung: Die Stärkefolien sind nicht wasserfest! Sorgt also dafür, dass eure Valentinsherzen stets im Trockenen bleiben. Für die Beschriftung habe ich dementsprechend einen Permanentschreiber mit organischem Lösungsmittel verwendet.

Was passiert da?
Was ist Stärkemehl?
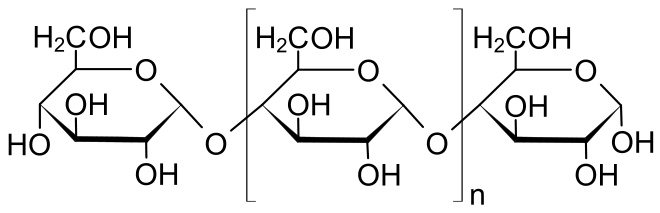
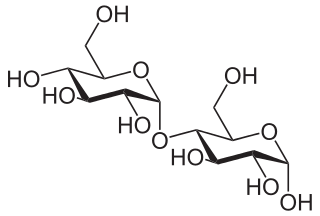
Stärke besteht aus grossen Kettenmolekülen, sogenannten Polymeren, die aus Tausenden miteinander verknüpften Glucose- also Traubenzucker-Ringen besteht. Pflanzen stellen diese Polymere her, um ihren Traubenzucker, der ihnen als Energieträger dient, ordentlich „aufgefädelt“ zu lagern.
Es gibt zwei verschiedene Sorten Stärkepolymere:
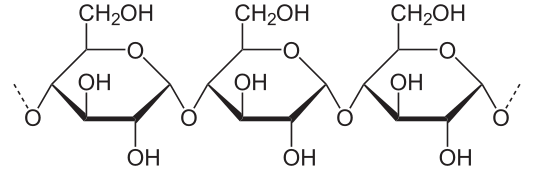
- Amylose, die aus einfachen Ketten aus wenigen Tausend aneinandergereihten Glucose-Einheiten besteht.
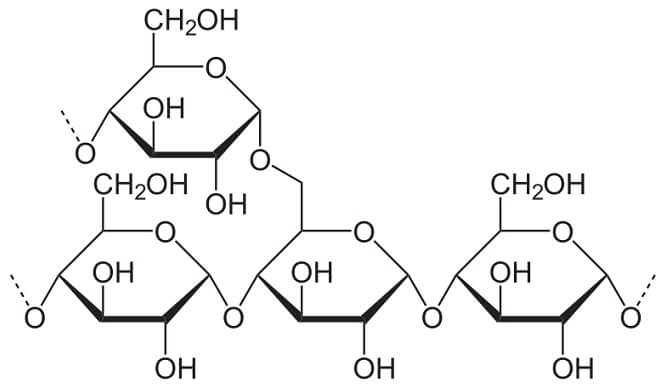
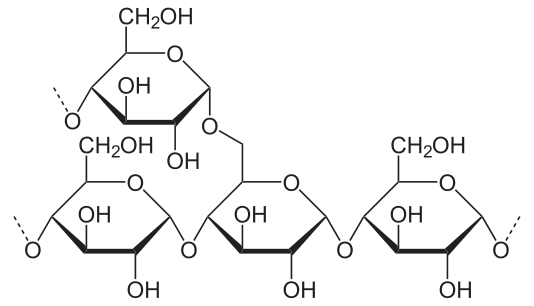
- Amylopektin, dessen Ketten sich etwa alle 30 Glucose-Ringe verzweigen. So entstehen regelrechte Molekül-Büschel, die gut und gerne Zehntausende oder gar Hunderttausende Glucose-Ringe umfassen können.
Trotzdem sind „Maizena“ und andere Stärkemehle weit von den Eigenschaften entfernt, die wir von Kunststoffen, also „Plastik“ kennen. Im Stärkemehl sind diese Molekülketten nämlich sorgfältig zu kleinen Körnern zusammengepackt. Dabei besteht jedes Korn aus etlichen Schichten, die säuberlich um seinen Mittelpunkt herum gelagert sind – in etwa wie die Schichten einer Zwiebel. Damit ähnelt ein Stärkekorn sehr einem Kristall, also der am regelmässigsten aufgebauten Sorte Festkörper, die es gibt. Und Kristalle, ob nun die von Salz und Zucker oder von Mineralien wie Bergkristall, haben freilich wenig mit nachgiebigen Kunststoffen gemein.

Stärke und Wasser: Eine besondere Beziehung
In einem unterscheiden sich Stärkekörner aber völlig von den üblichen Kristallen: Die Stärkepolymere können zwischen ihren Ketten kleine Moleküle festhalten! Aus der Schule bekannt ist der Stärkenachweis durch darin eingelagerte Jod-Moleküle, die die Ketten dunkel färben (wie ihr den Nachweis mit jodhaltigen Desinfektionsmitteln aus der Hausapotheke daheim durchführen könnt, erfahrt ihr hier).
Doch besonders Amylopektin ist in der Lage, sich auch grosse Mengen Wassermoleküle „einzuverleiben“. Die Wassermoleküle dringend zwischen die Verästelungen der Amylopektinbüschel und beanspruchen reichlich Platz. Die Folge: Die Büschel und damit auch die ganzen Stärkekörner quellen auf. Die vormals fest einsortierten Molekülketten werden so beweglich und können zunehmend aus ihren Positionen verrutschen.
Wenn nun Wärme hinzukommt – die nichts anderes ist als Bewegung von Molekülen und ihren Gliedern – rutschen und wirbeln die Stärkeketten und -zweige durcheinander, bis ein furchtbares Gewirr entsteht, das keine (mir bekannte) Macht der Welt wieder auflösen kann. Aus den vormals festen Stärkekörnern in Wasser ist ein mit Wasser vollgesogenes Molekülwirrwarr geworden, das wir als gelartige Masse wahrnehmen und „Stärkekleister“ nennen. Tatsächlich besteht Tapetenkleister aus quellender Stärke oder Zellulose-Varianten!
Lassen wir simplen Stärkekleister ausgestrichen an der Luft liegen, verdunsten die aufgesogenen Wassermoleküle mit der Zeit und das Molekülwirrwarr fällt in sich zusammen. Dabei bleibt es jedoch unverändert verworren, sodass es nun einen einzigen Festkörper bildet – allerdings hart und spröde. Und hier kommt das Glycerin ins Spiel.
Von der Platte zur Folie dank Weichmacher
Glycerin ist ein Alkohol mit mehren OH-Gruppen an einem Kohlenstoff-Grundgerüst. Dank der OH-Gruppen kann es ähnlich mit der Stärke wechselwirken wie Wasser – und dementsprechend zwischen den Ketten Platz finden – verdunstet von dort aber weniger leicht. Ausserdem kann Glycerin selbst Wassermoleküle besser bei sich behalten als die Stärke. So sorgt das zu unserem Stärkekleister gegebene Glycerin dafür, dass die Stärkefolien nicht ganz und gar austrocknen, sondern flexibel bleiben.
Das Glycerin übernimmt in unserem Biokunststoff also die Rolle des Weichmachers. Für uns ist es dabei allerdings harmlos, selbst wenn es aus der Stärkefolie freigesetzt wird. Als Bestandteil jedes natürlichen Fettes kommt es naturgemäss in unseren Körpern vor, sobald diese Fettmoleküle zerlegen. So ist es auch als Lebensmittelzusatzstoff E 422 als Feuchthaltemittel ohne Höchstmengenbeschränkung zugelassen. (In Reinform trinken solltet ihr Glycerin dennoch nicht, da es auch dem Körper eine Menge Wasser entziehen und damit in rauen Mengen zur Dehydrierung führen kann!)
Polymergewirr auch bei „richtigen“ Kunststoffen
Auch in den alltäglichen Kunststoffen, die wir überall um uns herum finden, sind lange Polymer-Ketten zu mehr oder minder dichtem Molekül-Filz verstrickt und zuweilen sogar über chemische Bindungen miteinander vernetzt. Die Dichte eines solchen Filzes bzw. die Engmaschigkeit seiner Vernetzung bestimmen die Härte oder Biegsamkeit des Kunststoffs. Eingelagerte Weichmacher können einen entscheidenden Einfluss auf die Flexibilität des Materials haben.
In elastischen Kunststoffen („Gummi“) verhalten sich die Ketten zudem ähnlich wie Spiralfedern: Sie können aus ihrer natürlichen verkrümmten Lage hinaus gerade(r) gezogen werden und kehren anschliessend wieder in ihre Ausgangshaltung zurück.
Ihr molekülfilz-artiger Aufbau gibt unseren Kunststoffen ihre enorme Formbarkeit und Robustheit, die wir sonst nur von Biopolymeren kennen (Holz und Pflanzenteile aus Zellulose sind ebenfalls sehr elastisch – beobachtet einmal Bäume bei starkem Wind! – und bedenkt die gleichzeitige Biegsamkeit und Festigkeit von menschlichem Haar, das aus Faserproteinen besteht!).
Entsorgung
Reste von Stärkekleister, Lebensmittelfarbe und Glycerin könnt ihr in den Ausguss bzw. Hausmüll entsorgen. Übrige Glyzerinlösung könnt ihr aber problemlos für spätere Versuche aufbewahren. Der Stärkekleister lässt sich mit Wasser leicht von Gefässen und Besteck entfernen.
Und wem schenkt ihr euer Herz aus selbstgemachtem Biokunststoff?
Hast du das Experiment nachgemacht:
[poll id=“3″]
Wenn etwas nicht oder nur teilweise funktioniert haben sollte, schreibt es in die Kommentare. Ich helfe gerne bei der Fehlersuche!