Mit Essig und Soda (oder Natron – das ist chemisch eng mit der Soda vewandt) könnt ihr eine Menge Partyspass haben. Warum das nicht am Valentinstag mit den schmelzenden Herzen von letztem Jahr verbinden? Inspiriert dazu haben mich – passend zum Namen – die Inspiration Laboratories!
Statt einem grossen Herzen habe ich dieses Jahr viele kleine gemacht, und zwar nicht aus Wasser, sondern aus gefrorenem Essig. Wenn ihr schon über Streusalz gelesen oder den Eiswürfelkran ausprobiert habt, wisst ihr vielleicht noch, dass Wasser mit etwas drin einen niedrigeren Gefrierpunkt hat als reines Wasser. Das gilt auch für 10% Essigsäure in Wasser. Haushalts- bzw. Reinigungsessig aus dem Supermarkt ist nämlich genau das. Aber da ein gutes Gefrierfach bis zu -18°C erreicht, ist das kein Problem.
Ein Essig-Soda-Spektakel mit gefrorenem Essig – geht das?
Wenn flüssiger Essig mit Soda-Pulver reagiert, entsteht dabei genug Gas, um einen Vulkan oder gar eine Rakete anzutreiben. Was aber wenn der Essig gefroren ist, die Essigsäuremoleküle in einem Eiskristall gefangen sind? Probieren wir es aus!

Experiment: Essigherzen in Sodalösung schmelzen
Zwei Feststoffe miteinander zur Reaktion zu bringen, ist etwas mühsam. Deshalb löse ich das Soda-Pulver in Wasser auf. So verteilen sich die Ionen, aus welchen die Soda besteht, im einzeln und fein im Wasser. Damit können wir sicher sein, dass sie den Essig im gefrorenen Herzen auch finden.
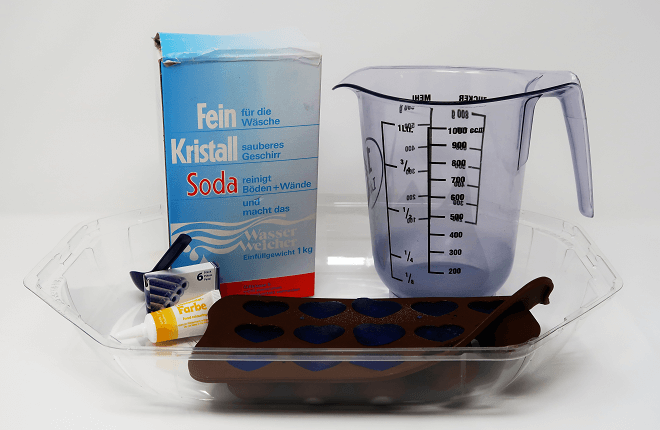
Ihr braucht dazu
- Haushaltsessig
- Soda oder Natron zum Waschen oder Backen
- Leitungswasser
- eine Form für herzförmige Eiswürfel oder Konfekt (am besten eine flexible aus Silikon)
- ein Gefäss mit Giesse
- Lebensmittelfarbe oder Tinte (zwei unterschiedliche Farbtöne)
- Einmal- oder Putzhandschuhe, wenn ihr nicht gern bunte Finger habt
- eine Schutzbrille für jeden Mitforscher, insbesondere dann, wenn ihr keine normale Brille tragt
- eine flache Schale oder Wanne
Sicherheitshinweis
Essig ist eine schwache Säure, Soda eine schwache Base. Mit Wasser vermischt können beide Stoffe in der Regel gefahrlos angefasst werden. Vermeidet aber Kontakt mit euren Augen! Eine normale Brille schützt teilweise vor Spritzern, eine Schutzbrille mit geschlossenen Seiten ist aber sicherer.
Falls doch etwas ins Auge geht: Spült das Auge mindestens 10 Minuten lang mit fliessendem Wasser und wendet euch allenfalls an euren Augenarzt!
So geht’s
- Um bunte Finger zu vermeiden tragt bei allen Schritten Handschuhe.
- Füllt Essig in das Gefäss mit Giesse und mischt Lebensmittelfarbe oder Tinte hinein.
- Füllt die Aussparungen der Eiswürfelform mit dem gefärbten Essig. Ihr müsst sie nicht ganz voll machen, denn Wassereis wächst (das Eis essighaltigen Wassers auch)!
- Stellt die Eiswürfelform mit Essig für einige Stunden ins Gefrierfach.
- Füllt ein Gefäss, in dem ihr gut rühren könnt, mit Wasser und rührt einige Löffel Sodapulver hinein (am besten so viel wie sich löst). Die Soda sollte sich möglichst vollständig auflösen.
- Mischt etwas Lebensmittelfarbe oder Tinte (den zweiten Farbton) in die Sodalösung.
- Gebt die Sodalösung 1-2cm hoch in die flache Schale und legt ein gefrorenes Essigherz hinein. Beobachtet und wiederholt das Ganze mit einem oder mehreren Herzen – ganz wie ihr wollt!
Was ihr beobachten könnt
Schon wenige Sekunden nachdem ich ein tintenblaues Herz in meine gelbe Sodalösung gelegt habe, fängt es leise an zu zischeln und Gasblasen lösen sich vom Rand des Eisherzes. Die blaute Tinte verteilt sich dabei in Schlieren in der gelben Lösung. Irgendwann richtet die Spitze des sich auflösenden Herzens nach oben auf.

Was hier geschieht
Der gefrorene Essig reagiert tatsächlich mit der Sodalösung!
Ein Einblick in die Chemie dahinter
Soda ist ein Salz, das aus Natrium- und Carbonat-Ionen besteht beim Auflösen in Wasser in diese beiden zerlegt wird.
Na2CO3 —-> Na+(aq) + CO32-(aq)
Das „(aq)“ vermerkt dabei, dass die damit markierten Stoffe in Wasser gelöst sind.
Das Carbonat-Ion (CO32-) ist eine Base: Es nimmt gerne Wasserstoff-(H+-)-Ionen auf. (An die versierten Chemiker unter euch: Es ist natürlich eine so starke Base, dass es auch mit Wasser reagiert, aber um das Ganze einfach zu halten, lasse ich diese Einzelheit hier aus!)
Essig ist hingegen eine Säure: Er gibt gerne ein Wasserstoff-Ion an die nächstbeste Base ab. Auch dafür kommt Wasser in Frage, aber wenn eine Base wie Carbonat zur Hand ist, reagiert die Essigsäure (CH3-COOH) um so bereitwilliger damit:
2 CH3-COOH(aq) + CO32-(aq) —-> 2 CH3-COO–(aq) + H2CO3(aq)
Die beiden Produkte, die dabei entstehen, sind eine weniger starke Säure bzw. Base als die beiden Ausgangsstoffe. Deshalb nennen Chemiker diese Reaktion eine Neutralisation.
Die Kohlensäure, die bei dieser Neutralisation entsteht, ist nicht stabil und zerfällt von selbst in Wasser und Kohlenstoffdioxid (CO2) – das Gas, welches sich in Bläschen von den gefrorenen Herzen löst:
H2CO3(aq) —-> H2O + CO2(g)
Wie der gefrorene Essig den Ablauf der Reaktion verändert
Dabei entsteht aber kein schäumendes Inferno wie beim Leucht-Vulkan. Statt frei im Wasser herum zu schwimmen sind die Essigsäuremoleküle hier nämlich im Essig-Eiskristall gefangen.

Das bedeutet, nur die Moleküle an der Oberfläche des Eisherzens können gleichzeitig mit der Soda reagieren und im Zuge dessen herausschmelzen. Erst danach können die Moleküle in der Schicht darunter reagieren und so fort.
So läuft die sonst stürmische Reaktion hier langsam und gesittet ab – passend für einen gemütlichen Tag der Liebe.
Im Übrigen ist auch das CO2-Gas dafür verantwortlich, dass die Spitze des Herzchens sich irgendwann aufstellt: Es sammelt sich unter dem Eisherz und bricht irgendwann an seinem schmaleren nde aus. Mit einem ordentlichen Blubb steigt die Gasblase an die Wasseroberfläche und hebt dabei das schmale und damit leichtere Ende des Eisherzens mit an.
Entsorgung
Essig und Soda sind eine schwache Säure bzw. schwache Base. Wenn ihr sie zusammengebt, neutralisieren sie einander überdies. Lebensmittelfarben und kleine Mengen Tinte sind ungiftig. So können Reste der Lösung zusammen- und in den Ausguss gegeben werden.
Feste Soda-Reste könnt ihr für weitere Experimente aufheben und übrigen Essig zum Reinigen verwenden.
Varianten und weitere Ideen
Das farbenfrohe Experiment eignet sich prima, um damit herum zu probieren: Schiebt zum Beispiel die Wanne mit der Sodalösung ein wenig an, sodass kleine Wellen entstehen und verfolgt das Farbenspiel um die sprudelnden Herzen.
Und was passiert eigentlich, wenn man die Sodalösung einfriert und Soda-Eisherzen in flüssigen Essig legt?
Ich freue mich davon zu hören, wenn ihr dieses Experiment nachmacht: Welche Varianten habt ihr probiert, und was ist euch noch zum Austesten eingefallen?
Hast du das Experiment nachgemacht:
[poll id=“12″]
Wenn etwas nicht oder nur teilweise funktioniert haben sollte, schreibt es in die Kommentare. Ich helfe gerne bei der Fehlersuche!










































 Stellt das Glas dann ab und wartet einige Minuten. Das Öl wird sich erneut über dem Wasser in einer eigenen Schicht sammeln – aber jetzt ist es rot!
Stellt das Glas dann ab und wartet einige Minuten. Das Öl wird sich erneut über dem Wasser in einer eigenen Schicht sammeln – aber jetzt ist es rot!








