Tenside – von dieser Stoffklasse hat bestimmt jeder schon einmal irgendwo gehört – aber weiss denn auch jeder, was Tenside eigentlich sind?
Auf meinen Rundgang durch den Haushalt entdecke ich sie überall: Auf der Packung meines Universal-Waschmittels heisst es „enthält 5 – 15% anionische Tenside sowie < 5% nichtionische Tenside. In meinem Handgeschirrspülmittel sind es sogar 15 bis 30% anionische Tenside und < 5% nichtionische und amphotere Tenside.
Aber Tenside finden sich auch andernorts, zum Beispiel in Lebensmitteln wie Kakaopulver für Trinkschokolade oder in Unkrautvernichtern, die auch den berüchtigten Wirkstoff Glyphosat enthalten.
Was hinter der Bezeichnung „Tensid“ jedoch steckt, mag überraschen: Sie steht für eine Gruppe von Chemie-Produkten, die schon seit rund 5000 Jahren von Menschen genutzt werden! Wie der Chemische Reporter berichtet, haben die Sumerer nämlich vor ebenso langer Zeit schon Seife hergestellt und verwendet. Und Seife ist ein Stoff, wenn nicht der Stoff, der aus Tensiden besteht.
Wie man Seife macht
Die Ursprünglichsten der Tenside lassen sich vergleichsweise einfach herstellen – nämlich aus pflanzlichen Fetten. Bei Fetten – unter Chemikern auch Triglyzeride genannt – handelt es sich nämlich um Ester des Glyzerins mit verschiedenen Fettsäuren. Und Verbindungen der Gruppe der Ester können ziemlich einfach zerlegt werden, zum Beispiel durch Zugabe einer Base.
Eine Base ist ein Stoff, der H+-Ionen aufnehmen kann, die er zum Beispiel Wassermolekülen „entwenden“ kann. Das führt dazu, dass Basen in Wasser häufig OH–-Ionen erzeugen, falls sie solche nicht selbst schon mitbringen:
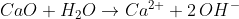
Calciumoxid – besser: Das Oxid-Anion – ist eine Base und reagiert mit Wasser zu zwei Hydroxid-Ionen. Das Calcium-Ion bleibt dabei in Wasser gelöst zurück.
Calciumoxid und weitere wasserlösliche Oxide der Alkali- und Erdalkalimetalle finden sich in Pflanzenasche, sodass die Asche basisch reagiert. Und das haben schon die findigen Sumerer zu nutzen gewusst (obwohl die noch nicht wussten was Basen sind), indem sie Asche zu warmen Pflanzenfetten gaben und eine weiche, aber formfeste Masse mit erstaunlichen Eigenschaften erzeugten: Seife. Heutzutage wird Seife noch genauso hergestellt – nur verwendet man anstelle der Asche Natriumhydroxid (NaOH), ein Salz, das mit Wasser die stark basische Natronlauge bildet.
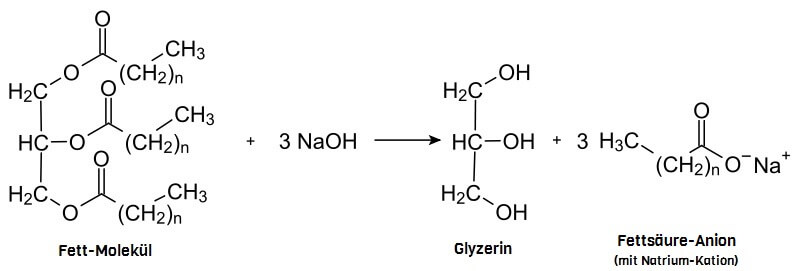
Seifenherstellung: Reaktion von Fetten mit einer Base zu Glyzerin und Fettsäure-Anionen
Wer Seife selbst herstellen möchte, findet hier ein Rezept dafür. Natriumhydroxid und Natronlauge sind jedoch stark ätzende Substanzen, die mit gebührender Vorsicht verwendet werden sollten!
Einfache Seife ist also ein Gemisch aus Glyzerin und den Anionen der verschiedenen Fettsäuren (eine gute Seife enthält praktisch keine Hydroxid-Ionen mehr, was erreicht wird, indem die Base bei der Herstellung etwas unterdosiert zum Einsatz kommt, sodass sie während der „Reifezeit“ der Seife von mehreren Wochen praktisch vollständig aufgebraucht wird). Und diese Fettsäure-Anionen sind ganz besondere Moleküle: Sie wechselwirken nämlich auf zweierlei Art mit ihrer Umgebung!
Mischung oder Trennung: Alles eine Frage der Anziehung
Die Art und Weise, wie ein Molekül mit anderen Molekülen in seiner Nachbarschaft wechselwirkt, hängt von der Verteilung der Elektronenladung im Molekül ab. Wenn diese nämlich ungleichmässig ausfällt, können Anhäufungen von negativer und positiver Ladungen in verschiedenen Molekülen einander anziehen. Und solche Anhäufungen gibt es, weil verschiedene Atomsorten ihre Elektronen (einschliesslich derer, die an Elektronenpaar-Bindungen beteiligt sind) unterschiedlich stark zu sich hinziehen. So entstehen polare, d.h. unsymmetrische Bindungen. Wie das im Einzelnen vor sich geht und welche Folgen das hat, könnt ihr in der Geschichte um die 13 Vitamine nachlesen.
Festzuhalten ist: Wenn in einem Molekül räumlich getrennte Anhäufungen von Elektronenladung entstehen (man spricht dann von einem Dipol-Molekül), können sich diese Anhäufungen und Bereiche mit einem Mangel an Elektronenladung gegenseitig anziehen. Und wenn Moleküle einander anziehen, lassen die Stoffe, welche aus ihnen bestehen, sich mischen.
Wasser ist der vielleicht bekannteste Stoff, der aus Dipol-Molekülen besteht. Und Stoffe, die sich mit Wasser mischen lassen, die also ebenfalls aus Dipol-Molekülen bestehen, nennt man hydrophil (griechisch für „wasserliebend“).
Auch in vielen organischen Molekülen gibt es solch unregelmässige Ladungsverteilung. Dazu zählen die sogenannten Carbonsäuren – solche Moleküle, die eine Carboxyl-Gruppe beinhalten.
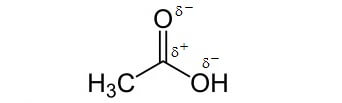
Essigsäure, eine einfache Carbonsäure, mit Anhäufungen von Ladung
Essigsäure ist eine einfache Carbonsäure. Die Carboxyl-Gruppe enthält Kohlenstoff- und Sauerstoff-Atome, auf welche die Elektronenladung nicht gleichmässig verteilt ist. So können die Essigsäure-Moleküle einander, aber auch andere Moleküle mit ungleichmässiger Ladungsverteilung anziehen: Essigsäure ist deshalb sehr gut mit Wasser mischbar!
Moleküle aus ähnlich „starken“ Atomen, deren Elektronenladung weitgehend gleichmässig verteilt ist, können keine Dipole sein. Und trotzdem ziehen sie einander an – auf eine andere Weise, die sich massgeblich von der Anziehung zwischen Dipolen unterscheidet. Moleküle mit gleichmässiger Ladungsverteilung lassen sich deshalb gut miteinander mischen, jedoch nicht Molekülen, welche die Anziehung zwischen Dipolen bevorzugen!
Da die Fette zu den „gleichmässigen“ Molekülen zählen, nennt man Stoffe aus solchen Molekülen lipophil (griechisch „fettliebend“).
Ein einfaches Modell für ein vielseitiges Molekül
Das Besondere an Fettsäure-Anionen ist: Sie sind sowohl hydrophil als auch lipophil! Das heisst allerdings nicht, dass sie sich gleichermassen gut mit Wasser und mit Fetten mischen lassen. Es sind vielmehr unterschiedliche Abschnitte der Moleküle, die entweder hydrophil oder lipophil sind.
So heissen Fettsäuren wie sie heissen, weil sie Carbonsäuren sind. Das heisst, ein Fettsäuremolekül enthält eine Carboxylgruppe, die ein H+-Ion abgeben und zur Carboxylat-Gruppe werden kann, dank welcher die Fettsäure zum Fettsäure-Anion wird. Und ein Anion enthält eine Extremform der Anhäufung von Elektronenladung: Diese Anhäufung ist so gross, dass ihre elektrische Ladung derer eines oder mehrerer ganzer Elektronen entspricht (Die Ladungs-Anhäufungen in Dipol-Molekülen sind stets kleiner als die Ladung eines Elektrons!).
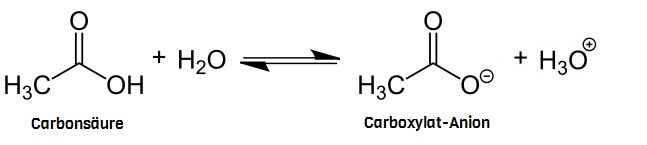
Und Carboxylgruppen sind (wie Carboxylat-Gruppen auch) hydrophil.
Allerdings befindet sich die Carboxylgruppe einer Fettsäure am Ende einer langen Atom-Kette aus Kohlenstoff- und Wasserstoff-Atomen. Und die sind in Sachen Elektronen-Anziehen nahezu gleich stark. Deshalb sind solche Kohlenwasserstoff-Ketten lipophil.
Während die Carboxylatgruppe eines Fettsäure-Anions also mit Wasser mischbar ist, ist seine Kohlenwasserstoff-Kette mit Fett (und nicht mit Wasser) mischbar. Und beide sind fest miteinander verbunden! Solch ein Molekül gleicht damit einer Schlange: Der Kopf beisst, und der Schwanz kann sich um einen Ast winden. Beide zusammen ergeben ein Tier, das in Bäumen Beute jagen kann.
Oder noch einfacher: Die Carboxylatgruppe sei wie der Kopf eines Streichholzes, der sich an einer Reibefläche entzünden lässt, während die Kohlenwasserstoff-Kette den Schaft zum Festhalten der Flamme bildet.
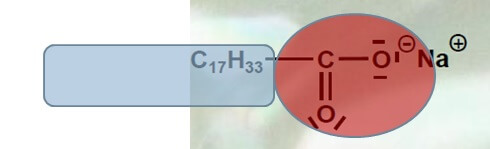
Carboxylat-Anion als „Streichholz“: Der rote Kopf ist wasserliebend, der blaue Schaft ist fettliebend.
Damit brauchen wir uns nicht länger mit Atomen, Atomgruppen und ungleichmässig verteilter Elektronenladung herum zu schlagen. Es genügt zu wissen: Die Streichholz-Köpfe mischen sich mit Wasser, die Streichholzschäfte mit Fett und anderen lipophilen Stoffen. Deshalb heissen solche „Streichholz“-Teilchen amphiphil – beides liebend – oder auch „Tensid“.
Die Fettsäure-Anionen, deren „Köpfe“ also eine negative Ladung tragen, gehören zu den „anionischen“ Tensiden. Doch auch Fettsäuren, welche ihr H+-Ion nicht abgegeben haben, sind amphiphil. Sie gehören mangels einer ganzen elektrischen Ladung zu den nichtionischen Tensiden. Ebenso gibt es kationische Tenside mit einer positiven ganzen Ladung am Kopf, und schliesslich amphotere Tenside, die sowohl eine positive als auch eine negative Ladung am Kopf tragen.
Wie Seife funktioniert: Streichholz-Tenside und Grenzflächen
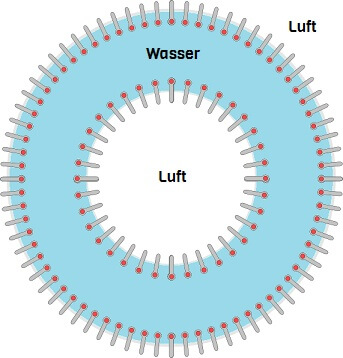
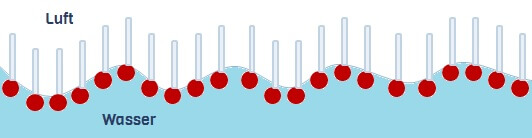
Stellt man ein Gefäss mit Wasser an der Luft, hat man zwei Stoffe oder Stoffgemische direkt nebeneinander, die unterschiedlich wechselwirken: Wasser ist hydrophil, während die meisten Luftmoleküle (Luft besteht hauptsächlich aus Stickstoff, N2 und Sauerstoff, O2) lipophil sind. Folglich wollen beide nicht viel miteinander zu tun haben und bilden ihre eigenen Cliquen. Wassermoleküle halten sogar so stur zusammen, dass sie die meisten Luft-Moleküle strikt draussen halten.
Teilchen, die aus der Luft ins Wasser oder umgekehrt passieren möchten, müssen damit Auflagen erfüllen und Mühen auf sich nehmen wie wir mancherorts, wenn wir eine Landesgrenze überschreiten wollen. Dementsprechend wird solch eine trennende Fläche zwischen Luft und Wasser (aber auch zwischen anderen Stoffen) Grenzfläche genannt.
Das Bollwerk, das die zusammenhaltenden Wassermoleküle an der Wasseroberfläche bilden zeigt sich uns als „Oberflächenspannung“: Es ist so fest, dass kleine Tiere wie Wasserläufer darauf laufen können!
Wenn man Seife (Tenside) ins Wasser gibt, sortieren die sich in der bequemsten Ausrichtung – an der Grenzfläche zwischen Luft und Wasser, sodass die hydrophilen Köpfe ins Wasser und die lipophilen Schwänze in die Luft weisen! Damit stören sie den Zusammenhalt der Wassermoleküle an der Oberfläche so empfindlich, dass jeder Wasserläufer auf Seifenwasser umgehend untergehen würde.
Das könnt ihr ganz einfach ausprobieren – aber bitte nicht mit Tieren! Als Ersatz für einen Wasserläufer schwimmt auch eine eiserne Büroklammer (seiner Dichte wegen sollte Eisen sofort sinken!) auf Wasser, wenn man sie vorsichtig darauf legt. Sobald man jedoch Seife in eine Schale Wasser gibt, auf welchem eine Büroklammer schwimmt, wird diese umgehend untergehen.
Die Oberfläche des Wassers in einem Behälter hat jedoch eine begrenzte Grösse. Wenn man genügend Seife hineingibt, wird sie irgendwann gänzlich von Tensiden besetzt sein, sodass die Übrigen keinen Platz mehr finden werden. Diesen ausgegrenzten Molekülen bleibt nichts anderes übrig, als Zuflucht in „Selbsthilfegruppen“ zu suchen: Sie lagern ihre Schwänze so zu einer Kugel zusammen, dass alle Schwanzenden auf deren Zentrum weisen. Damit befinden sich alle Köpfe aussen – dem Wasser zugewandt – sodass sich diese Tensid-Kugeln wunderbar mit dem Wasser mischen können, während ihr lipophiler Anteil in ihrem Inneren verborgen bleibt. Solche Kugeln oder ähnlich abgeschlossenen Tensid-Gebilde werden von Chemikern auch Mizellen genannt.
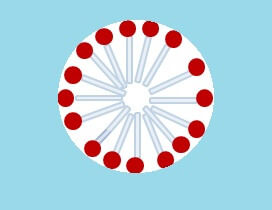
Das Geheimnis der Superwaschkraft
Die Fähigkeit zur Bildung von Mizellen ist auch das Geheimnis der Waschkraft von Seife. Jeder, der schon einmal versucht hat, eine fettige Pfanne bloss mit Wasser zu reinigen, wird festgestellt haben, dass das Fett sich von Wasser reichlich wenig beeindruckt zeigt und kaum von der Stelle weicht. Taucht man die Pfanne samt Fett jedoch in seifenhaltiges Wasser, eröffnen sich für die Tenside darin ganz neue Möglichkeiten:
Jetzt können sich die lipophilen Schäfte nämlich an die Oberfläche der Fettpartikel anlagern und diese dicht an dicht besetzen. So verschaffen die Tenside den Fetten eine mit Wasser mischbare Oberfläche aus „Streichholzköpfen“. Das Ganze geht sogar so weit, dass die Tenside sich regelrecht zwischen Fettpartikel und Pfannenoberfläche drängen, sodass die Partikel bald abgelöst werden und als vollständig geschlossene „Mizellen mit was drin“ durch das Wasser treiben und weggespült werden können!
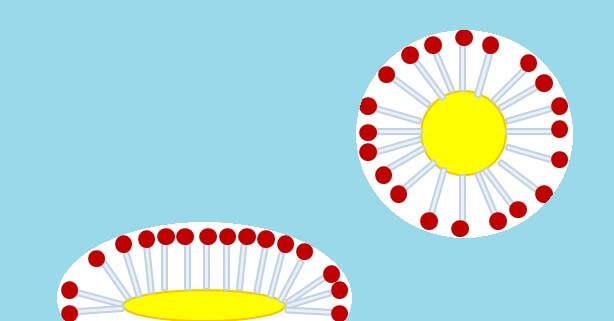
Tenside als Spielzeug
Nicht nur für die Waschkraft von Seife zeichnen Tenside verantwortlich, sondern auch für ein seit Generationen beliebtes Spielzeug: Seifenblasen. Wenn man die kauft, erhält man meist einen handlichen Kunststoffzylinder mit einer Seifenlösung und einem kleinen Ring am Stab zum Hineintauchen. Wenn man den Ring aus der Lösung nimmt, spannt sich darin ein dünner Film aus Seife, der sich, sobald man sanft hineinbläst, zu einer Blase ausdehnt, abschnürt und in schillernden Regenbogenfarben langsam durch die Luft davontreibt.
Aber woraus bestehen die ätherischen, fast gewichtslos wirkenden Seifenblasen eigentlich?
Hauptsächlich aus Tensiden, die eine besonders trickreiche Anordnung einnehmen! Ausserhalb und innerhalb einer Seifenblase befindet sich nämlich Luft, sodass es sich anbietet, an der Innen- und Aussenfläche einer Seifenblase Schwänze zu haben. Tatsächlich ordnen sich die Tenside dicht an dicht zu einer doppelten Schicht, wobei alle Schäfte der inneren Schicht nach innen und jene der äusseren Schicht nach aussen weisen. Folglich weisen alle Streichholzköpfe in die Mitte zwischen den Schichten. Und da bietet es sich an, gleich noch eine sehr dünne Schicht Wassermoleküle zwischendrin einzuschliessen, damit es zwischen einzelnen Ladungen der gegenüberliegenden Köpfe nicht zu Abstossung kommt.
Die Anziehung zwischen den geordneten Tensiden ist damit so gross, dass sie selbst in bewegter Luft zu einem hauchdünnen, aber sichtbaren Film zusammenhalten und die eingeschlossene Wasser-Schicht tragen können….fast zumindest. Denn wer Seifenblasen genau beobachtet, wird feststellen, dass sie in der Regel zerplatzen bevor sie ganz zu Boden gleiten oder auf ein Hindernis treffen. Und wer besonders grosse Seifenblasen macht und noch genauer hinschaut (oder eine Zeitlupenkamera sein Eigen nennt), mag bemerken, dass die Blasen zuerst oben aufreissen, ehe sie ganz zerfallen.
Das zeigt uns, dass die Schwerkraft am Ende doch gewinnt. Früher oder später werden die Wassermoleküle der Zwischenschicht nämlich doch zu schwer und in der Seifenblassen-Hülle nach unten gezogen. Dort sammeln sie sich an, während die Blase im oberen Bereich zunehmend trocken fällt – bis sich die Tensid-Köpfe schliesslich berühren und abstossen. So gerät die geniale Streichholz-Doppelschicht gänzlich aus den Fugen und reisst auseinander. Die einstmals schillernde Blase wird wieder zu einem schlichten, ungeordneten Tropfen Seifenlösung, der eben dort landet, wo die Seifenblase ihr kurzes Dasein beendet hat.
Tenside als Bausteine des Lebens
Auch in und um Lebewesen gibt es zahlreiche mehr oder minder überwindbare Grenzflächen wie jener zwischen Luft und Wasser. So atmen Landsäugetiere wie wir Menschen Sauerstoff-Moleküle, indem wir ihnen ermöglichen, in unseren Lungenbläschen aus der Luft hinaus und in unsere wasserhaltige Blutbahn einzutreten. Wasserlebewesen bewerkstelligen das Gleiche in ihren Kiemen, die dafür geschaffen sind, im Wasser gelösten Sauerstoff in den Körper hinein zu lassen.
Um mit solchen und vielen anderen Grenzflächen umzugehen, hat sogar das Leben seine ganz eigenen Tenside geschaffen! Diese Moleküle unterscheiden sich in vielerlei Hinsicht von Seife, können jedoch ebenfalls in einen hydrophilen Kopf und einen lipophilen Schwanz gegliedert werden. Aus solchen Tensiden besteht zum Beispiel die Aussenhülle von Körperzellen: Dabei handelt es sich um eine doppelte Schicht aus dicht gepackten „Streichhölzern“, deren Schäfte allesamt nach innen und die Köpfe nach aussen weisen – also quasi um eine umgekehrte Seifenblase. Das ist praktisch, weil sowohl das Innere der Zelle mit Wasser (und vielem anderen) gefüllt ist, als auch Wasser die Zellen im Körper umgibt. Da die Hülle der Zellen jedoch innendrin lipophil sind (dort befinden sich die Tensid-Schäfte!), können sich das Wasser draussen und das Wasser drinnen nicht einfach vermischen! Was hydrophil ist und in die Zelle hinein- oder aus ihr hinaus soll, muss durch speziell dafür vorgesehene „Fenster-“ oder „Tunnel-„Moleküle hindurch.
Wann Tenside zum Problem werden
Der Umstand, dass viele Lebewesen sich hervorragend mit den Grenzflächen zwischen ihnen selbst und ihrem Lebensraum „draussen“ arrangiert und allerlei Tricks entwickelt haben, um ihrer Umgebung Nahrung und Sauerstoff zu entnehmen, führt dazu, dass viele Tenside, die wir erfunden haben um ebensolche Grenzflächen zu zerstören (um zum Beispiel Fettreste mit Wasser lösen zu können), für solche Lebewesen giftig sind. Das gilt besonders für Wasserlebewesen, welche die dichten Grenzflächen ihres Lebensraums in vielerlei Hinsicht zum Leben brauchen.
Deshalb müssen die Seifen und anderen Tenside, die wir tagtäglich verwenden, erst abgebaut werden, bevor sie in die Umwelt gelangen dürfen! Das besorgt zum Beispiel ein Klärwerk, in dem Bakterien für genau diesen Job „angeheuert“ werden. Diese Bakterien, die sich im Klärbecken über Tenside hermachen, haben zum Beispiel die zwei folgenden Möglichkeiten, die „Streichholz“-Moleküle unschädlich zu machen:
- Sie trennen den Streichholzkopf vom Schaft. Damit bleiben zwei Teilmoleküle, eines wasser- eines fettliebend, die jedes für sich ihre Lieblingsumgebung suchen und keinen Schaden mehr anrichten können.
- Sie verpassen dem Schaftende einen zweiten Kopf. So entsteht ein zweiköpfiges „Streichholz“, das nach beiden Enden wasserliebend ist und somit für das Zusammenspiel der Tenside nicht mehr brauchbar ist.
Wer also ein nützliches Tensid „erfinden“ möchte, tut gut daran, nicht nur über die mögliche Giftigkeit des Tensids nachzudenken. Wenn nämlich dessen Abbauprodukte, welche die Bakterien im Klärwerk daraus herstellen, für sich aus irgendeinem Grund ebenso giftig sind, würde die Entsorgung der Tenside damit ihres Sinnes beraubt.
So sind die Seifen unseres täglichen Gebrauchs wohl für viele Wasserlebewesen gefährlich, aber auch für den Abbau im Klärwerk geschaffen. Aus diesem Grund gehört Seifenwasser unbedingt in einen Haushaltsabfluss entsorgt, der an ein Abwassersystem und damit möglichst direkt an eine Kläranlage angeschlossen ist.
Innerhalb eines Gebäudes ist das hierzulande kein Problem. Ein Auto passt jedoch in den seltensten Fällen ins Haus, und das Seifenwasser samt Öl- und anderen Resten beim Autowaschen einfach in die Gegend laufen zu lassen erachten viele wichtige Lebewesen in Wasser und Boden als ganz schlechte Idee (und ist je nach Art des vorhandenen Entwässerungssystems sogar verboten!). Deshalb verdient jedes Auto, das nach einer Wäsche mit Seife verlangt, eine Fahrt durch eine Autowaschanlage, die eine umweltschonende Entsorgung ihrer Abwässer übernimmt.
Richtig problematisch wird es damit erst, wenn Tenside zum Einsatz kommen, um Unmischbares zu mischen, das dazu bestimmt ist, in der Landschaft verteilt zu werden. So stecken in Pflanzenschutzmitteln, die (nicht nur) den berüchtigten Wirkstoff Glyphosat enthalten, in der Regel auch Tenside. Und die gelangen beim Spritzen von Pflanzen auf Äckern und in Gärten ungehindert in die Umwelt, was, wie Sebastian auf Nullius in Verba schreibt der Abschnitt über die Tenside findet sich am Schluss des Beitrags) , die Problematik des eigentlichen Glyphosats, letztlich in den Schatten stellt!
Fazit
Tenside gehöhren in Form von Seife zu den am längsten von Menschen genutzten Chemikalien der Welt. Ihre Fähigkeit auf zweierlei Weise mit ihrer Umgebung zu wechselwirken und Grenzflächen durchlässig zu machen macht sie zu starken und vielseitigen Helfern im Alltag. Wo Grenzflächen allerdings lebensnotwendig sind, werden Tenside schnell zur Gefahr. So nützlich ihre Superwasch- und mischkraft auch ist, setzt Seife und andere Tenside mit Bedacht ein und geniesst ihren Nutzen ohne bitteren Beigeschmack!
Und wo begegnen euch Tenside in eurem Alltag?