Was sind Vitamine? Warum sind Vitamine fett- oder wasserlöslich? Wozu brauchen wir die Vitamine? Warum muss der Mensch Vitamine aufnehmen und wo findet er sie? Kann man zu viele Vitamine haben?
Wer kennt sie nicht, die Aufforderungen wohlmeinender Mütter, wir mögen unser Gemüse und den Salat essen, mit allen Vitaminen, die darin seien? Die zahllosen Fernseh-Werbespots von Herstellern, die ihren Produkten mit dem Unterstreichen eines fantastischen Vitamingehalts einen gesunden Anstrich zu geben suchen?
Wer hat sich hingegen schon gefragt, was das für Stoffe sind, die da so eifrig beworben werden und warum und wozu wir sie eigentlich brauchen? Dieser Artikel soll eine Übersicht über die Vitamine geben, die der Mensch zum Leben benötigt (auch Tiere brauchen Vitamine, aber nicht unbedingt die gleichen wie der Mensch). Dabei liegt der Schwerpunkt jedoch nicht wie auf vielen anderen Seiten bei Tagesbedarf und Mangelsymptomen, sondern auf den Aufgaben der einzelnen Vitamine im Organismus und den Eigenschaften, nach welchen man diese vielfältigen Moleküle ordnet.
Was sind Vitamine?
Vitamine und andere Nahrungsergänzungsmittel liegen hoch im Trend. Die Regale in Supermärkten und Drogerien sind voll davon, und mein Hausarzt hat eine besondere Vorliebe für Vitamin C zur begleitenden Therapie von fast allem. In der Kosmetik-Branche wird Vitamin A als Jungbrunnen für die Haut gehandelt. Aber welche Wunderstoffe verbergen sich hinter diesen kaum aussagekräftigen Buchstabenkürzeln?
Vitamine sind kleine organische Moleküle, die für höhere Tiere (dazu gehört auch der Mensch!) lebenswichtig sind, und die diese Organismen nicht selbst herstellen können.
Der Name rührt übrigens daher, dass man früher irrtümlicherweise alle Vitamine für Amine (eine Stoffklasse, deren Mitglieder mit dem Ammoniak verwandte Stickstoff-Atomgruppen enthalten) hielt und entsprechend aus lat.: vita (Leben) und Amin ein Kunstwort als Bezeichnung schuf.
Und das war es dann auch mit den Gemeinsamkeiten der Vitamine. Tatsächlich verbirgt sich hinter diesem Namen eine Vielzahl verschiedener Stoffe mit ebenso verschiedenen Funktionen.
Welche Vitamine gibt es?
Der menschliche Organismus braucht im Wesentlichen 13 verschiedene Stoffe, die er nicht selbst herstellen kann. Sie alle sind unter verschiedenen Namen und Kürzeln auf Verpackungen von Lebensmitteln oder Vitamin-Präparaten anzutreffen – und natürlich auch in deren Inhalt. Diese 13 Stoffe werden in wasserlösliche und fettlösliche Vitamine eingeteilt.
| Vitamin A |
Retinol |
E 160a (beta-Carotin) |
fettlöslich |
| Vitamin B1 |
Thiamin |
|
wasserlöslich |
| Vitamin B2 |
Riboflavin |
E 101 |
wasserlöslich |
| Vitamin B3 |
Niacin |
|
wasserlöslich |
| Vitamin B5 |
Pantothensäure |
|
wasserlöslich |
| Vitamin B6 |
Pyridoxin |
|
wasserlöslich |
| Vitamin B7, H |
Biotin |
|
wasserlöslich |
| Vitamin B9 |
Folsäure |
|
wasserlöslich |
| Vitamin B12 |
Cobalamin |
|
wasserlöslich |
| Vitamin C |
Ascorbinsäure |
E 300, 301, 302 |
wasserlöslich |
| Vitamin D |
Calciferol |
|
fettlöslich |
| Vitamin E |
Tocopherol |
E 306 – 309 |
fettlöslich |
| Vitamin K |
Phyllochinon |
|
fettlöslich |
Tabelle 1: Die 13 Vitamine für den Menschen (nach [1] und nutri-facts.org)
Warum sind Vitamine fett- oder wasserlöslich?
Eine Lösung im Sinne der Chemie ist ein homogenes Gemisch zweier Stoffe. „Löslichkeit in“ kann bei der Einteilung der Vitamine also auch durch „Mischbarkeit mit“ ersetzt werden. Wie gut sich zwei Stoffe miteinander mischen lassen, hängt von den anziehenden Wechselwirkungen zwischen ihren Molekülen ab.
Polare Bindungen ziehen sich an
Die Natur dieser Wechselwirkungen hängt damit zusammen, wie die Elektronen der Atome in den jeweiligen Molekülen im Molekül verteilt sind. Eine Elektronenpaar-Bindung zwischen zwei Atomen ist nämlich weder so starr noch so symmetrisch, wie der Strich, mit welchem man sie in einer Strukturformel darstellt, es vermuten lässt.
Vielmehr ziehen die verschiedenen Atomsorten „ihre“ Elektronen ungleich stark zu sich hin (diese Eigenschaft wird Elektronegativität genannt: Je höher die Elektronegativität eines Atoms ist, desto stärker zieht es Elektronen an). Das resultiert innerhalb eines Moleküls in einem regelrechten Tauziehen zwischen den Atomen: Das stärkere, an einer Bindung beteiligte Atom zieht „seine“ Bindung zu sich hin, während dem schwächeren Atom am anderen Ende relativ wenig von den Elektronen ebendieser Bindung bleibt.
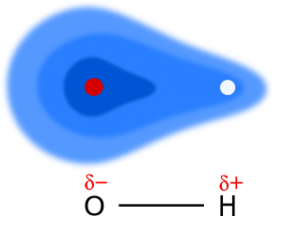
Ladungsverteilung entlang einer polaren Bindung: Je dunkler blau eine Fläche, desto wahrscheinlicher ist ein Elektron darin anzutreffen. Die Wahrscheinlichkeit dafür ist rund um das stärkere (elektronegativere) Sauerstoffatom wesentlich grösser als um das schwächere Wasserstoffatom. Delta + und Delta – markieren einen Ladungsüber- oder unterschuss, welcher kleiner ist als die Ladung eines Elektrons.
So „entzogene“ Elektronen können die Kernladung des schwächeren Atoms natürlich nicht mehr ganz ausgleichen, während sie am stärkeren Atom sogar zu einem negativen Ladungsüberschuss führen. Die so entstehenden elektrischen Ladungen betragen nur einen Bruchteil der Ladung eines ganzen Elektrons, haben jedoch gravierende Auswirkungen auf die Eigenschaften eines Moleküls. Denn entgegengesetzte elektrische Ladungen ziehen einander an, was dazu führt, dass Moleküle, die solche verschobenen „polaren“ Bindungen enthalten, einander anziehen: Die Sieger beim atomaren Tauziehen ziehen die Verlierer des nächsten Moleküls an und umgekehrt. Das Resultat ist eine anziehende Wechselwirkung zwischen den Molekülen.
Auch unpolare Bindungen ziehen sich an – auf ganz andere Weise
Doch auch zwischen Molekülen, in welchen die Atome an den Enden ihrer Bindungen gleich „stark“ sind, gibt es eine anziehende Wechselwirkung. Entlang solcher „unpolaren“ Bindungen entstehen äusserst kurzzeitig, jedoch stetig aufs Neue Ladungsunterschiede, wenn die beteiligten Elektronen zwischen den Atomen hin und her schwingen. Und das tun sie andauernd. Die so entstehenden Ladungen für den Augenblick ziehen sich auf ihre ganz eigene Weise gegenseitig an.
Diese beiden Wechselwirkungen sind in einer Weise verschieden, welche dazu führt, dass sie nicht miteinander kompatibel sind. Moleküle verschiedener Sorten lassen sich also nur zueinander bringen, wenn sie vornehmlich zur gleichen Art von Wechselwirkungen befähigt sind.
Wie du die Löslichkeit eines Stoffs an seiner Strukturformel abschätzt
Und diese Befähigung lässt sich an der Strukturformel eines organischen Moleküls abschätzen, wenn man ganz wenige Dinge weiss:
1. Kohlenstoff- und Wasserstoffatome sind in etwa gleich stark.
2. Sauerstoffatome sind sehr stark und gewinnen gegen Kohlenstoff und Wasserstoff immer.
3. Stickstoffatome sind ebenfalls stark und gewinnen gegen Kohlenstoff und Wasserstoff, jedoch nicht gegen Sauerstoff.
4. Moleküle mit polaren und unpolaren Bindungen sind zu Wechselwirkungen beider Art fähig. In kleinen Molekülen überwiegt bei ausgewogener Verteilung unterschiedlicher Bindungen jedoch die polare Wechselwirkung.
Wasser enthält demnach zwei stark polare Bindungen. Es wird sich also gut mit anderen polaren Molekülen mischen lassen. So verwundert es nicht, dass auch die Moleküle der wasserlöslichen Vitamine reichlich polare Bindungen haben, während die fettlöslichen Vitamine über weiter Strecken aus unpolaren Kohlenstoff-Wasserstoff-Ketten bestehen (wie Fette auch).
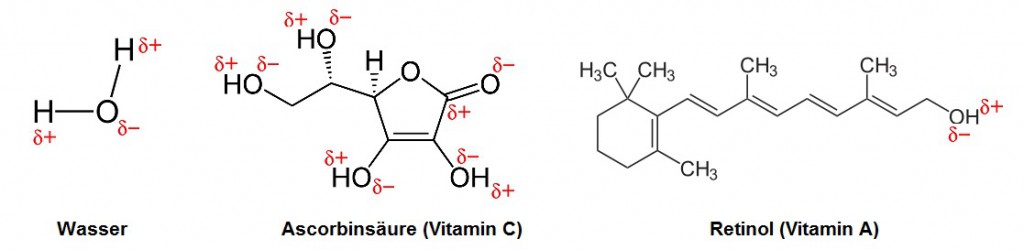
Löslichkeit ausgewählter Vitamine:
Ascorbinsäure besitzt über das ganze Molekül verteilt polare Bindungen und ist somit gut mit Wasser mischbar.
Retinol besitzt nur eine polare Bindung, während der grösste Teil des Moleküls aus unpolaren Bindungen aufgebaut ist. Damit lässt sich Retinol nicht mit Wasser, dafür jedoch mit fettartigen Stoffen, die ebenfalls hauptsächlich unpolare Bindungen enthalten, gut mischen.
Wozu brauchen wir die 13 Vitamine?
Die wasserlöslichen Vitamine werden vielerorts gebraucht. Wasser ist im menschlichen Organismus allgegenwärtig, sodass die Mischbarkeit der Vitamine mit Wasser ihre Beweglichkeit und damit ihre Verteilung erheblich fördert.
Die B-Vitamine
Die B-Vitamine sind direkte Vorstufen zur Herstellung von Coenzymen: Enzyme sind hochkomplexe, leistungsstarke Katalysatoren, die hauptsächlich aus Peptidketten – miteinander verbundenen Aminosäuren – bestehen. Diese Ketten lassen sich zu vielfältigen Formen falten und reagieren auf verschiedenste Weise miteinander oder mit ihrer Umgebung.
Peptide können aber nicht alles. Deshalb haben die meisten Enzyme zusätzliche Bestandteile, die keine Peptidketten sind und nach der Herstellung des Proteins angefügt werden müssen. Sind diese Bestandteile kleine organische Moleküle, nennt man sie Coenzyme. Ohne Coenzyme oder andere Zusatz-Bestandteile können viele Enzyme ihre Aufgabe im Stoffwechsel – das Katalysieren von ganz bestimmten Reaktionen – nicht erfüllen. Da oftmals viele verschiedene Enzyme auf das gleiche Coenzym zurückgreifen, ist es von Vorteil, wenn die B-Vitamine im ganzen Organismus verfügbar sind.
Ascorbinsäure (Vitamin C)
Ascorbinsäure ist ein Antioxidans, das zum Beispiel zur Kollagen-Herstellung nötig ist: Kollagen ist ein faserartiges Protein, das wie ein Seil aus drei verdrillten Ketten „geflochten“ ist. Es ist überall dort gefragt, wo Zusammenhalt von Nöten ist: In der Haut, Sehnen, Bändern, Blutgefässwänden, Knochen, aber auch in Zahnfleisch und Zähnen. Damit ein Kollagen-„Seil“ wirklich hält, müssen die Ketten „klebrig“ sein – mit anderen Worten: die einzelnen Ketten – jede ein riesiges Molekül – müssen miteinander wechselwirken. Dazu wird die Aminosäure Prolin an bestimmen Positionen in der Peptidkette des Kollagens mit einer zusätzlichen OH-Gruppe versehen.
OH-Gruppen enthalten eine polare Bindung, die zu einem Extrem der polaren Wechselwirkung fähig ist: Das Sauerstoff-Atom gewinnt das Tauziehen um die O-H-Bindung haushoch, während das Wasserstoff-Atom gleich in doppelter Hinsicht als Verlierer dasteht. Die beiden Elektronen, welche die O-H-Bindung bilden, sind nämlich seine einzigen. So wird der Kern des Wasserstoff-Atoms geradezu entblösst, wenn ein stark elektronegatives Atom wie Sauerstoff diese Bindung zu sich hinzieht. Zum Ausgleich zieht es so entblösste Wasserstoffkerne zu anderen, elektronenreichen Atomen besonders hin. Wenn ein solches Atom ein „ungenutztes“ (nichtbindendes) Elektronenpaar hat, findet der entblösste Wasserstoffkern darin etwas „Deckung“. Das Resultat ist eine vergleichsweise stark anziehende Wechselwirkung, die Wasserstoff-Brücke genannt wird.
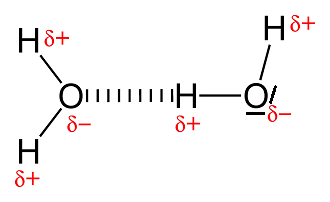
Wasserstoff-Brücken zwischen Wassermolekülen: Ein Sauerstoff-Atom ist stark genug um den Kern eines benachbarten Wasserstoff-Atoms zu „entblössen“ – und es hat zwei nichtbindende Elektronenpaare (dargestellt am rechten Molekül), die jeweils einem Wasserstoff-Kern Deckung bieten können. Neben Sauerstoff sind ausserdem nur die Atome der Elemente Stickstoff und Fluor in der Lage Wasserstoffbrücken zu bilden!
Das Kollagen-Seil klebt also über Wasserstoffbrücken zwischen den einzelnen Ketten zusammen. Das Enzym, welches das Anfügen der OH-Gruppen an Prolin katalysiert, die Prolin-Hydroxylase, oxidiert dazu das Prolin und reduziert im Gegenzug das Molekül α-Ketoglutarat (Eine Redox-Reaktion ist eine Elektronenübertragung: Oxidation und Reduktion sind untrennbar miteinander verbunden). Wenn aber einmal kein Prolin zur Hand ist, reduziert das Enzym α-Ketoglutarat und oxidiert dafür sich selbst – und wird damit unbrauchbar. Dann kann Vitamin C (bzw. das Anion der Ascorbinsäure) das Enzym reduzieren (und wird dabei selbst oxidiert) und damit reaktivieren [1].
Ohne Vitamin C würde der Organismus sein Kollagen mangels aktiver Prolin-Hydroxylase zunehmend ohne OH-Gruppen und Wasserstoffbrücken herstellen. Solches Kollagen kann Gewebe nicht gut zusammenhalten, was zu brüchigen Blutgefässen, instabilem Zahnfleisch und anderen Problemen führt, mit anderen Worten zu Skorbut.
Die fettlöslichen Vitamine interagieren bei ihren Aufgaben häufig mit anderen fettlöslichen Molekülen, sodass ihnen ihre Mischbarkeit mit solchen zum Vorteil gereicht.
Retinol (Vitamin A)
Retinol ist am Sehvorgang, an Wachstum bzw. Regeneration von Gewebe und an der Fortpflanzung beteiligt. Es ist als Mittel für gute Nachtsicht und Anti-Aging-Wirkstoff für die Haut sehr populär.
Auf der Netzhaut (Retina) im Auge sind lichtempfindliche Zellen, ihrer Form nach „Stäbchen“ genannt, für die Hell-Dunkelsicht verantwortlich. Die Stäbchen enthalten ein Protein namens Rhodopsin, welches ein direkt aus Vitamin A hergestelltes Molekül enthält. Dieses „11-cis-Retinal“ verändert seine Struktur, wenn Licht darauf fällt (es wird zu all-trans-Retinal) und löst damit eine Signalkaskade aus, die letztlich die Information „es ist hell“ an das Gehirn weiterleitet. Wenn bei wenig Licht (nachts halt) die für das Farbensehen zuständigen „Zapfen“-Zellen nicht mehr funktionieren, ist der Mensch ganz auf die Stäbchen angewiesen. Ein Mangel an Vitamin A, also Retinol, zur „Ausrüstung“ der Stäbchen führt deshalb zur zunehmenden Einschränkung unserer Nachtsicht-Fähigkeit. [1],[2].
Cholecalciferol (Vitamin D3)
Cholecalciferol ist die Vorstufe eines Hormons, das den Calcium- und Phosphatstoffwechsel reguliert und damit z.B. für den Einbau von Calcium in die Knochensubstanz unverzichtbar ist. Vitamin-D-Mangel führt somit vor allem zu Störungen des Knochenwachstums, aber auch der Knochenerhaltung. Die Folgen werden bei Kindern im Wachstum als Rachitis, bei Erwachsenen als Osteomalazie bezeichnet [1].
Tocopherol (Vitamin E)
Tocopherol ist ein Antioxidans, das ähnlich wie Vitamin C wirkt, aber im Gegensatz dazu fettlöslich ist. Seine Aufgaben sind das „Fangen“ von Radikalen (hochreaktiven Molekülbruchstücken) und anderen oxidierend wirkenden Stoffen, indem es sie reduziert. Da Vitamin E fettlöslich ist, verrichtet es diese Aufgabe vornehmlich in der Umgebung anderer fettlöslicher Moleküle, wo Vitamin C nicht so leicht hinkommt. Das können Membranlipide (fettähnliche Verbindungen in Zell- und anderen Membranen, Lipidproteine oder unsere Fettdepots sein, die so allesamt vor Schäden durch Oxidation geschützt werden.
Phyllochinon (Vitamin K)
Phyllochinon bzw. Vitamin K (K wie Koagulation = Blutgerinnung) ist als Coenzym an der Biosynthese von Gerinnungsfaktoren, zum Beispiel des Proteins Prothrombin, beteiligt. Unter Einwirkung von Phyllochinon werden bestimmte Aminosäuren am Ende der Peptidkette des Prothrombins so verändert, dass sie fest an Calcium-Ionen binden können. So findet das Prothrombin an der Oberfläche von Blutplättchen an einer Verletzung Halt und kann von dort vorhandenen Enzymen aktiviert werden. Dazu wird ein Teil der Peptidkette (Thrombin) abgespalten und kann seinerseits weitere Gerinnungsfaktoren (z.B. durch Spaltung von Fibrinogen) aktivieren. Ohne Vitamin K würde der Organismus unverändertes Prothrombin herstellen, welches nicht am Ort seiner Bestimmung haften und somit nicht zur Blutgerinnung führen könnte [1].
Warum kann der Körper die Vitamine nicht selbst herstellen?
Dass wir Vitamine zu uns nehmen müssen, ist eine Folge von „Erbkrankheiten“, die sich bei den Vorfahren des Menschen und verschiedener heutiger Tiere vor Jahrmillionen entwickelt haben.
Vitamin C zum Beispiel können die meisten Tiere heutzutage selbst herstellen. Auch beim Menschen und anderen Trockennasenprimaten (also allen Affen sowie Koboldmakis) ist ein Stoffwechselweg dafür entwickelt. Allerdings ist bei gemeinsamen Urahnen dieser Arten (den Menschen eingeschlossen) vor 61-74 Millionen Jahren eine Mutation des Gens für das Enzym L-Gulonolactonoxidase aufgetreten. Dieses Enzym katalysiert den letzten Schritt zur Herstellung von Vitamin C in unserem Organismus. Die Mutation (ein Fehler in der Gensequenz, dem Bauplan für das Enzym) führte dazu, dass die Nachfahren jener Urahnen-Spezies keine funktionsfähige L-Gulonolactonoxidase mehr herstellen können.
Die Ur-Spezies, die diesen Gendefekt entwickelte, hat davon vermutlich nichts mitbekommen, da sie reichlich Vitamin C-haltiges Obst zum fressen hatte. Auch die heutigen Affen leiden gewöhnlich nicht an Vitamin C-Mangel, da sie reichlich ascorbinsäure-reiche Nahrung auf ihrem Speiseplan stehen haben und damit ihre „Erbkrankheit“ ganz unbewusst und sehr erfolgreich selbst „behandeln“. Einzig der Mensch ist zwischenzeitlich auf die abwegige Idee gekommen, er käme ohne Früchte aus und könne z.B. nur mit Schiffszwieback verpflegt über die Weltmeere segeln (bis zahlreiche Todesfälle aufgrund von Skorbut im 18. Jahrhundert zur näheren Beschäftigung mit Nahrungsmittel-Inhaltsstoffen führten). Meerschweinchen, echte Knochenfische, einige Sperlingsvögel und Fledertiere haben übrigens einen ähnlichen Gendefekt und sind daher ebenso auf Vitamin C in der Nahrung angewiesen. [3]
Wie kommen wir zu unseren Vitaminen?
Die meisten Vitamine sind Bestandteile unserer Nahrung. Als Vitamin-Präparate werden sie häufig bei Mangelerscheinungen oder vorsorglich bei unausgewogener Ernährung, erhöhtem Bedarf (Krankheit, Schwangerschaft, Medikamenten-Nebenwirkungen, Stress,…) oder Stoffwechselstörungen zugeführt. Dabei ist zu beachten, dass nur die fettlöslichen Vitamine (und Vitamin B12) in begrenztem Umfang im Organismus gespeichert werden können. Alle anderen müssen sehr regelmässig aufgenommen werden.
Während die meisten B-Vitamine fast ausschliesslich in tierischen Produkten zu finden sind, sind die übrigen zumeist in pflanzlicher Nahrung enthalten. Der Mensch ist also nicht umsonst ein „Allesfresser“ – er braucht all diese Nahrungsmittel gleichermassen.
| Vitamin A (Retinol) |
Leber, Eigelb, Milch und Milchprodukte, als Beta-Carotin in Karotten, gelbem und dunkelgrünem Blattgemüse, Palmöl |
| Vitamin B1 (Thiamin) |
Brauhefe, Schweinefleisch, Vollkorngetreide, Nüsse, Hülsenfrüchte |
| Vitamin B2 (Riboflavin) |
Hefe, Leber, Milch und Milchprodukte, Eier, grünblättrige Gemüse, Fleisch |
| Vitamin B3 (Niacin) |
Hefe, Leber, Geflügel, mageres Fleisch, Nüsse, Hülsenfrüchte (Niacin-Verbindungen in Getreide sind für den Menschen nicht verwertbar!) |
| Vitamin B5 (Pantothensäure) |
Hefe, Innereien, Eier, Milch und Milchprodukte, Gemüse, Hülsenfrüchte, Vollkorngetreide |
| Vitamin B6 (Pyridoxin) |
Huhn, Leber, Fisch, Walnüsse, Erdnüsse, Vollkorngetreide, Mais |
| Vitamin B7 (Biotin) |
Hefe, Leber, Niere, Eigelb, Sojabohnen, Nüsse, Getreide |
| Vitamin B9 (Folsäure) |
Leber, dunkelgrünes Gemüse, Bohnen, Weizenkeime, Hefe; auch Eigelb, Milch und Milchprodukte, rote Beete, Orangen, Vollkorngetreide |
| Vitamin B12 (Cobalamin) |
Leber, Niere, Fisch, Eier, Milch und Milchprodukte |
| Vitamin C (Ascorbinsäure) |
Zitrusfrüchte, schwarze Johannisbeere, Paprika, grünes Gemüse, Erdbeere, Guave, Mango, Kiwi |
| Vitamin D (Calciferol) |
Sonnenlicht!!, ansonsten: Lebertran, Salzwasserfisch, wenig: Eier, Milch und Milchprodukte, Fleisch |
| Vitamin E (Tocopherol) |
Pflanzenöl, Nüsse, Vollkorngetreide, Weizenkeime, Samen, grüne Blattgemüse |
| Vitamin K (Phyllochinon) |
Grünblättrige Gemüse, einige Pflanzenöle, Haferflocken, Kartoffeln, Tomaten, Spargel, Milch und Milchprodukte |
Tabelle 2: Vorkommen der Vitamine in Nahrungsmitteln nach nutri-facts.org
Die grosse Ausnahme bildet Vitamin D (Calciferol). Dies ist das einzige der beschriebenen 13 Moleküle, das der menschliche Organismus selbst herstellen kann (und damit eigentlich gar kein Vitamin ist). Dass es trotzdem zu den Vitaminen gezählt wird, hängt damit zusammen, dass zur Biosynthese von Calciferol UV-B-Strahlung nötig ist. Und die kommt in der Regel von der Sonne, also von „aussen“.
Vitamin D entsteht in der Haut aus Cholesterin, genauer gesagt aus 7-Dehydrocholesterin. Einfallende UV-B-Strahlung kann einen Ring im 7-Dehydrocholesterin-Molekül öffnen, wodurch Prävitamin D3 entsteht, welches zum eigentlichen Cholecalciferol (Vitamin D3) weiterreagiert. In Leber und Niere kann daraus dann das weiter oben genannte Hormon Calcitriol hergestellt werden [1].
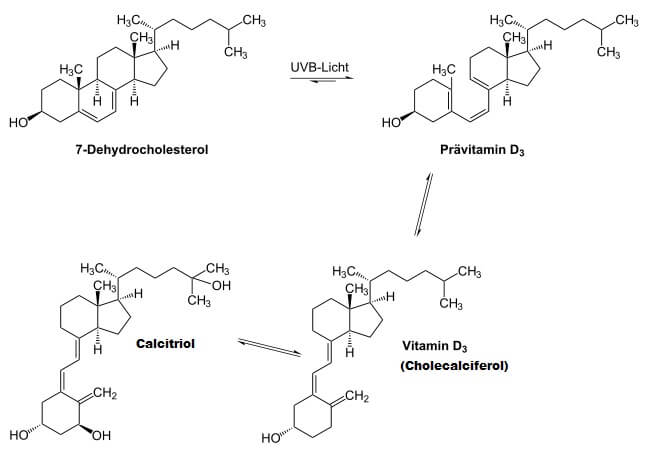
Biosynthese von Vitamin D und Calcitriol nach [1]
Im Lehrbuch für Biochemie [1] findet sich im Zusammenhang mit der Vitamin-D-Synthese eine Randnotiz, dass bei arabischen Beduinen-Frauen, die ihr Leben in Ganzkörperverhüllung verbringen, die Vitamin-D-Mangelerscheinung Osteomalazie auftritt – und dass, obwohl sie in der stets sonnenverwöhnten Wüste leben. Wer ständig eine Burka trägt ist also gut damit beraten auf eine ausreichende Vitamin-D-Zufuhr durch Nahrungsergänzung zu achten.
Ebenso stehen Vegetarier und vor allem Veganer vor der Herausforderung ihren Bedarf an B-Vitaminen zu decken und gegebenenfalls ihren Speiseplan mit Vitamin-Präparaten zu ergänzen.
Kann man zu viele Vitamine aufnehmen?
Im ersten Semester des Chemiestudiums fand ein Kommilitone im Praktikumslabor eine Kilopackung Ascorbinsäure (in Reinform ein weisses, kristallines Pulver) und fragte unseren Praktikumsassistenten, was denn wohl passieren würde, wenn er löffelweise davon ässe. Der Assistent antwortete: „Nichts“, und fügte hinzu, dass mein Kommilitone allenfalls vielleicht Sodbrennen oder/und Magenschmerzen bekäme, weil mehrere Gramm Ascorbinsäure auf einmal geschluckt vorübergehend zu Magenübersäuerung führen können.
Eine „Vergiftung“ (Hypervitaminose) mit wasserlöslichen Vitaminen ist tatsächlich kaum möglich und tritt allenfalls in exotischen Fällen auf (z.B. Langzeit-Überdosierung von Vitaminpräparaten oder seltene Stoffwechselkrankheiten), da sie im Organismus gut beweglich sind und über die Niere ziemlich ungehindert wieder ausgeschieden werden können.
Bei fettlöslichen Vitaminen sieht das etwas anders aus, denn sie können nicht so einfach über die Niere ausgeschieden werden und sammeln sich im Organismus an. Insbesondere die Vitamine A und D können akute und/oder chronische Vergiftungserscheinungen (bis hin zum Tod) hervorrufen.
Da sich die Vitamin-D-Synthese bei Sonneneinstrahlung jedoch selbst reguliert, kann eine Hypervitaminose D – wie alle anderen Vitamin-„vergiftungen“ – nur durch übermässige Zufuhr von Vitamin-Präparaten verursacht werden. Ebenso verhält es sich mit der Hypervitaminose A (es sei denn, man wäre auf einer Polarexpedition und würde den Fehler machen Eisbärenleber zu essen… Die ersten akuten Vitamin-A-Vergiftungen wurden bei Polarforschern dokumentiert, die eben dies getan hatten [4]).
Zusammenfassung
Der menschliche Organismus benötigt zur Aufrechterhaltung aller Funktionen 13 organische Stoffe, die er nicht eigenständig herstellen kann. Diese Stoffe werden als Vitamine zusammengefasst, obwohl ihre Struktur und Funktionen sehr vielfältig sind. Dabei lassen sich die Vitamine in wasser- und fettlösliche Stoffe ordnen. Die Anzahl und Verteilung von polaren Bindungen in ihren Molekülen lassen eine Einschätzung der Löslichkeit zu. Die Löslichkeit der Vitamine steht im Zusammenhang mit ihren Aufgaben und einer möglichen Giftwirkung bei Überdosierung.
Literatur
[1] Biochemie der Vitamine: J.M. Berg, John L.Tymoczko, L.Stryer: Biochemie. Spektrum Akademischer Verlag GmbH, Heidelberg, Berlin 2003
[2] Überblick über den Stoffwechsel einschliesslich Vitamin-Aufnahme und der Prozesse beim Sehen: S.Silbernagl, A.Despopoulos: Taschenatlas der Physiologie. Georg Thieme Verlag, Stuttgart 2003
[3] Genetik der Wirbeltiere bezüglich Ascorbinsäure (Vitamin C): G. Drouin, J. R. Godin, B. Pagé: The genetics of vitamin C loss in vertebrates. In: Current genomics. Band 12, Nummer 5, August 2011
[4] Giftigkeit der Vitamine: Dietrich Mebs: Gifttiere – Ein Handbuch für Biologen, Toxikologen, Ärzte und Apotheker. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 1992
Dietrich Mebs: Leben mit Gift: Wie Tiere und Pflanzen damit zurechtkommen und was wir daraus lernen können
(*)