Ein chemisches Element wird in der Ernährungsbranche immer wieder heiss diskutiert: Das Jod – oder Iod, wie die Wissenschaftler es schreiben. Ist Jod nun gesund oder für die Gesundheit schädlich? Wie kann dieses vielseitige Element uns nützen? Wie können wir die richtige Menge davon zu uns nehmen?
Eines vorweg: Jod ist für uns alle – insbesondere für die gesunde Entwicklung von Kindern – unverzichtbar. Deshalb habe ich für euch Antworten auf wichtige Fragen zu diesem wichtigen Stoff zusammengestellt. Aber fangen wir von vorn an:
Was ist eigentlich Jod?
Jod ist eines der wenigen Nichtmetalle unter den chemischen Elementen. Das Elementsymbol ist „I“ (in älteren Periodensystemen findet man auch noch ein „J“). Es gehört zur Gruppe der Halogene, die man im Periodensystem in der siebten Hauptgruppe (= Spalte) findet. Damit ist es chemisch mit den sehr aggressiven Gasen Fluor und Chlor und mit dem ebenfalls aggressiven aber flüssigen Brom verwandt: Wie diese besteht Jod aus Molekülen aus je zwei Atomen: I2.
Das Element Jod ist aus Chemikersicht etwas friedlicher als seine sehr aggressiven Verwandten. In unserer normalen Umgebung (Atmosphärendruck und Raumtemperatur) ist es zudem ein Feststoff: Jod bildet so dunkelviolette Kristalle, dass sie praktisch grauschwarz aussehen und zudem metallisch glänzen.
Eine bei Chemielehrern beliebte Besonderheit des Jods ist, dass es, wenn man es vorsichtig erwärmt, nicht schmilzt, sondern sofort verdampft (das direkte Verdampfen von Feststoffen nennen Chemiker und Physiker „Sublimieren“) – und der violette Dampf beim Abkühlen wieder zu Kristallen wird, ohne vorher zu kondensieren (das wird entsprechend „Resublimieren“ genannt).
Wenn Lehrer im Schulunterricht Jod sublimieren, dann tun sie das in der Regel in weitgehend geschlossenen Gefässen. Denn wenngleich weniger stark als seine Verwandten reagiert auch dieses Halogen rege mit seiner Umgebung, reizt die Haut, die Augen und kann die Atemwege schädigen. Deshalb gilt es als gesundheits- und umweltschädlich und muss mit den entsprechenden Gefahrensymbolen beschriftet werden.
Wie kann das ein Nährstoff sein?
In der Natur kommt Jod nicht als Element – dafür ist es zu reaktionsfreudig – sondern in chemischen Verbindungen vor. Wie Chlor und die anderen Halogene bildet es leicht einfach negativ geladene Ionen (I–, genannt Iodid) oder verbindet sich zum Beispiel mit Sauerstoff zu Ionen wie dem Iodat (IO3–), die Bestandteile verschiedener Salze sind. Oder Jod-Atome bilden eine Atombindung zu einem benachbarten Atom – zum Beispiel Kohlenstoff – das Ergebnis sind jodhaltige organische Verbindungen.
Und sowohl die Salze als auch die organischen Verbindungen des Jods haben ganz andere – für uns lebenswichtige – Eigenschaften als das Element!

Oben: Das Element Iod, bestehend aus I2-Molekülen. Die Dämpfe färben Kunststoffbehälter und -löffel braunviolett.
Unten: Das Salz Kaliumiodid , das I–-Ionen enthält, besteht aus farblosen Kristallen.
Jod für unsere Ernährung
Wofür braucht der menschliche Körper Jod?
Viele Funktionen des Energiestoffwechsels und Wachstumsvorgänge werden von Hormonen geregelt, die in der Schilddrüse – die vorn in unserem Hals zu finden ist – hergestellt werden. Und diese Schilddrüsenhormone sind organische Moleküle, die Jod enthalten. Damit die Schilddrüse solche Hormone herstellen kann, braucht sie natürlich Jod – und zwar in Form von Iodid-Ionen I–.
Triiodthyronin und Thyroxin – die Schilddrüsenhormone
Die beiden wichtigsten Schilddrüsenhormone, deren Konzentration im Blut der Arzt misst, um die Schilddrüsenfunktion zu überprüfen, sind das Triiodthyronin, kurz T3, und das Thyroxin, kurz T4.
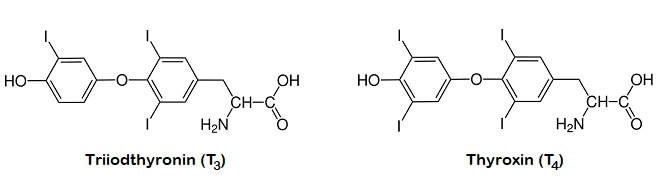
Die beiden wichtigsten Schilddrüsenhormone: Der Index am T steht für die Anzahl Jod-Atome im Molekül. T4 unterscheidet sich von T3 nur durch ein zusätzliches Jod-Atom am linken „Benzol-Ring“. Von beiden Molekülen gibt es übrigens je zwei Ausführungen, die einander gleichen wie Bild und Spiegelbild (solche Paare nennen Chemiker „Enantiomere“). Als Hormon wirksam ist aber jeweils nur eine Ausführung – die Chemiker mit dem Buchstaben L kennzeichnen (das gilt übrigens für praktisch alle Spiegelbild-Moleküle in der Biochemie: Nur mit der L-Ausführung kann der Organismus etwas anfangen!). Deshalb enthalten Tabletten zur Behandlung einer Schilddrüsenunterfunktion „L-Thyroxin“ (und nicht dessen wirkungsloses Spiegelbild D-Thyroxin).
Tatsächlich entsteht in der Schilddrüse hauptsächlich T4, das an Proteine angehängt seine Reise durch die Blutbahn antritt. Wenn es irgendwo im Körper gebraucht wird, kann das Hormon vom Protein abgekoppelt werden, sodass Zellen es aufnehmen können. Erst im Zellinneren wird dann ein Jod-Atom entfernt (genau: es wird gegen ein Wasserstoffatom (H) getauscht, welches in der Formel nicht mehr sichtbar ist) und so T3 erzeugt. Deshalb genügt es oft, bei einer Schilddrüsenunterfunktion nur T4 („L-Tyroxin“) einzunehmen, um beide Hormone zu ersetzen.
Der Jod-Haushalt und sein Manager
Damit die Schilddrüse bei Bedarf Hormone nachliefern kann, kann sie einen gewissen Vorrat an Iodid-Ionen aufnehmen. Allerdings kann sie nicht feststellen, wann der Körper Bedarf an T4 und T3 hat. Dafür ist die Hirnanhangdrüse zuständig. Der geben die im Blut vorhandenen Schilddrüsenhormone nämlich das Signal „Wir sind da, es braucht nicht mehr“. Wenn dieses Signal zu schwach wird oder gar ausbleibt, schickt die Hirnanhangdrüse das Hormon TSH (Thyroidea stimulierendes Hormon) auf die Reise, welches wiederum der Schilddrüse (auf medizinisch Thyroidea) sagt, dass sie Jod aufnehmen soll (sodass T4 (und T3) hergestellt werden kann).
Deshalb lässt der Arzt bei einer Schilddrüsenuntersuchung auch die Konzentration des TSH im Blut bestimmen: Ist die nämlich niedrig, obwohl es zu wenig Schilddrüsenhormone hat (oder hoch, obwohl es mehr als genug T4/T3 hat), dann ist das Problem bei der Hirnanhangdrüse zu suchen, anstatt bei der Schilddrüse selbst.
Jod als Spurenelement
Damit die Schilddrüse auf Anweisung durch TSH Iodid aufnehmen kann, muss in ihrer Umgebung natürlich welches vorhanden sein. Deshalb müssen Menschen (und andere Tiere) Jod-Verbindungen mit der Nahrung aufnehmen. Jod ist also ein echtes Spurenelement!
Jodmangel und seine Folgen
Fehlt uns das Jod, werden bald die Schilddrüsenhormone knapp. Die Folgen dessen sind Antriebslosigkeit, Neigung zur Gewichtszunahme, ein langsamer Herzschlag und andere Anzeichen fehlender Energie. Dazu kommt, dass der Körper aus dauerhaft fehlenden Schilddrüsenhormonen folgert: Wir brauchen mehr Schilddrüsengewebe (das solche Hormone herstellen kann)! So fängt die Schilddrüse bei lang anhaltendem Jodmangel mitunter zu wachsen an, was zu einer im Extremfall gewaltigen, „Kropf“ (medizinisch: „Struma“) genannten Schwellung am Hals führen kann.
Um ein beginnendes Kropf-Wachstum frühzeitig mitzubekommen und zu stoppen, vermisst der Arzt bei Patienten mit Schilddrüsenproblemen ab und zu die Schilddrüse mit dem Ultraschall-Gerät und vergleicht die Masse mit früheren Ergebnissen.
Besonders wichtig sind die Schilddrüsenhormone und damit das Jod jedoch für Ungeborene und kleine Kinder: Bei Jodmangel (oder nicht richtig arbeitender Schilddrüse) werden sowohl das Körperwachstum als auch die Entwicklung des Gehirns massiv behindert. Die Kinder bleiben kleinwüchsig, ihre Intelligenz und geistigen Fähigkeiten sind vermindert und sie leiden am Kropf und anderen körperlichen Auffälligkeiten.
Die extremsten Folgen von Jodmangel seit der frühen Kindheit – auf medizinisch „Kretinismus“ genannt – waren bis vor rund 100 Jahren hierzulande weit verbreitet. Besonders in den Bergregionen in der Schweiz und Österreichs traf man regelmässig auf Betroffene – so auch im zweisprachigen Kanton Wallis, in welchem diese tragischen Gestalten auf französisch als „Crétins des Alpes“ – in etwa „Idioten der Alpen“ – bezeichnet wurden (das französische Schimpfwort „crétin“ für „Dumpfbacke“ gibt es noch heute – hier hat es seinen Ursprung).
Warum litten so viele Bergbewohner an Jodmangel?
Jod kommt in der Natur meist in wasserlöslichen Verbindungen – genau: Salzen – vor. So kommt es, dass solche Jodverbindungen in Gegenden, in welchen es oft regnet, alsbald ausgewaschen und fortgespült wird. Und wenn kein Jod im Boden ist, können darauf wachsende Pflanzen keines aufnehmen, ebenso wenig wie die Tiere, die davon fressen. Und wir Menschen, die sich von den Pflanzen und Tieren ernähren, bekommen so erst recht wenig Jod ab.
An den Hängen grosser Gebirge regnet (und schneit) es nun besonders rege, sodass in Bergregionen besonders viel Jod ausgewaschen wird und den Bewohnern fehlt. Doch auch im Flachland und an den Meeresküsten Mitteleuropas gibt es reichlich Niederschlag, sodass selbst dort der Boden nicht genug Jod hergibt, um seine Bewohner ausreichend zu versorgen.
Wie beugt man dem Jodmangel heute vor?
Als man vor rund 100 Jahren dahinter kam, wie Kretinismus entsteht und warum so vielen Menschen an Jodmangel litten, hat man damit begonnen, Nahrungsmitteln bei der Herstellung gezielt Jod zuzufügen. Heute verwendet man dazu Salze, die das Iodat-Ion IO3– enthalten, wie das Natriumiodat NaIO3. Im Körper reagieren die Iodat-Ionen dann weiter zum benötigten Iodid (I–).
Die Iodate vermischt man entweder mit Speisesalz, welches entweder direkt an die Endkunden verkauft oder bei der Herstellung anderer Produkte wie Würsten, Kartoffelchips oder Fertiggerichten verwendet wird.
Oder man gibt die Iodate in das Kraftfutter für Kühe und Hühner, sodass sich das Jod in ihrer Milch und ihren Eiern wiederfindet.
In der Schweiz tut man seit 1922 von der Regierung angeleitet beides (ebenso wie in Deutschland und Österreich) – und 100 Jahre später sind die Folgen eindrücklich: Die durchschnittliche Jod-Versorgung der Bevölkerung in der Schweiz wie auch in Deutschland liegt heute im unteren Bereich dessen, was die WHO als wünschenswert ansieht. Die „Crétins des Alpes“ und entstellende Kropfleiden gibt es nicht mehr.
Zu letzterem trägt übrigens auch bei, dass Neugeborene heute in den ersten Lebenstagen auf angeborene Schilddrüsendefekte untersucht werden, sodass ein erblich bedingter Hormonmangel sofort behandelt werden kann. Da im Mittel aber nur eines von 5000 Babys mit so einem Defekt zur Welt kommt, können solche Fälle allein nicht für die einst weite Verbreitung des Kretinismus in den Alpen verantwortlich sein.
So könnt ihr euch selbst und eure Kinder mit genügend Jod versorgen
- Verwendet beim Kochen jodiertes Speisesalz – in der Menge, die einen gesunden Salzhaushalt fördert (wieviel Salz gesund ist, könnt ihr hier nachlesen)
- Wenn ihr euch vegan ernährt, achtet besonders sorgfältig auf eure Jodversorgung, da euch der wichtige Anteil der Jodzufuhr aus dem Tierfutter entgeht! Die Ovo-Lacto-Vegetarier und Fischesser unter euch haben es da einmal mehr einfacher. Denn neben Milch und Eiern ist auch Fisch aus dem Meer eine gute Jod-Quelle (ratet mal, wo das aus dem Boden ausgewaschene Jod hingespült wird…).
- Beachtet: Als Schwangere und stillende Mütter habt einen erhöhten Jodbedarf – ihr versorgt eure Kinder schliesslich mit!
- Lasst bei einem Verdacht auf Jodmangel die Jodversorgung bzw. Schilddrüsenwerte vom Arzt prüfen und sprecht mit ihm ab, was ihr an Nahrungsergänzungsmitteln oder Hormonen einnehmt. Der Jod- bzw. Schilddrüsenstoffwechsel ist eine sehr empfindliche Angelegenheit, sodass eine nicht genau angepasste Dosierung oder falsche Auswahl unliebsame bis fatale Folgen haben kann.
Jod als Notfallmittel für Atomunfälle
Natürliches versus radioaktives Jod
Es gibt eine ganze Reihe verschiedener Jod-Atomkerne (man nennt solche Kerne „Isotope“: Sie haben bei gleicher Protonenzahl eine unterschiedliche Anzahl Neutronen, sodass sie alle dem gleichen Element angehören und die gleiche Chemie zeigen, obwohl sie aus unterschiedlich vielen Kernteilchen bestehen). Jedoch ist nur einer davon nicht radioaktiv, nämlich das Jod-Isotop mit 127 Kernteilchen (53 Protonen und 74 Neutronen), kurz „Jod-127“.
Deshalb kommt in der Natur auch nur dieses eine Jod-Isotop vor (alle anderen, die früh in der Geschichte des Sonnensystems entstanden sein mögen, sind längst zerfallen). In Atomreaktoren, wo fleissig Atomkerne zertrümmert und umgeformt werden, entstehen jedoch auch radioaktive Jod-Atome. Und wenn die bei einem Reaktorunfall nach draussen gelangen, kann ein menschlicher Körper die radioaktiven Isotope nicht von natürlichem Jod unterscheiden – und lagert sie in die Schilddrüse ein, sobald er ihrer habhaft wird.
Die Strahlung, die von den radioaktiven Jod-Atomen direkt in der Schilddrüse ausgeht, kann das sie umgebende Gewebe schädigen und – so nimmt man an – Erkrankungen bis zum Schilddrüsenkrebs auslösen. Tatsächlich wurde eine Zunahme an Schilddrüsenkrebs-Erkrankungen unter Kindern und Jugendlichen in naher Umgebung des verunfallten Reaktors von Tschernobyl beobachtet (mehr zu diesem schrecklichen Unfall zu meinen Lebzeiten erfahrt ihr hier).
Wie man sich vor radioaktivem Jod schützen kann
Ein Weg die eigene Schilddrüse vor radioaktivem Jod aus einem Reaktorunfall zu schützen besteht darin, im Falle eines solchen Zwischenfalls den Körper mit natürlichem Jod regelrecht zu überschwemmen – und ihn so dazu zu veranlassen, den Jod-Speicher in der Schilddrüse bis unter die Decke aufzufüllen. Wenn ihm dann radioaktives Jod unterkommt, passt dort einfach nichts mehr hinein.
Deshalb werden in der Schweiz an alle Haushalte und Arbeitsorte im Umkreis von 50km um Kernkraftwerke Jodtabletten (sie enthalten Kaliumiodid, also I–-Ionen, die der Körper ohne Umwege einlagern kann) ausgegeben, die die Bewohner und Arbeitgeber vor Ort lagern und im Falle eines Unfalls sofort einnehmen können. Denn nur dafür sind sie gedacht: Die allermeisten radioaktiven Jodisotope zerfallen innerhalb von Tagen oder wenigen Wochen, sodass eine einmalige Überschwemmung mit nicht strahlendem Jod rechtzeitig nach dem Unfall in der Regel genügend Schutz bietet.
Ich habe übrigens keine Jodtabletten daheim – offenbar sind alle Atomkraftwerke weit genug entfernt, dass man uns genügend Zeit zubilligt, um im Ernstfall erst zur Apotheke zu gehen und welche zu holen. An meinem einstigen Arbeitsplatz in Uster im südöstlichen Kanton Zürich habe ich hingegen (auf der Suche nach einem Erste-Hilfe-Kasten) einige Packungen entdeckt.
Jod als Kontrastmittel
Einige organische Moleküle, die Jod-Atome enthalten, haben die für Mediziner nützliche Eigenschaft, dass sie Röntgenstrahlen schlucken können. Auch Körpergewebe – vor allem Knochen – besitzen solche Eigenschaften: Ein Röntgenbild entsteht, indem Röntgenstrahlen (eine energiereiche Form von Licht) durch den Körper auf einen lichtempfindlichen Film (bzw. einen entsprechenden digitalen Sensor) geschickt werden. Wenn etwas die Röntgenstrahlen auf ihrem Weg verschluckt („absorbiert“), wirft es einen weissen Schatten auf den Film.
Wenn ein Patient ein Kontrastmittel – zum Beispiel eine jodhaltige organische Verbindung – gespritzt bekommt, gelangt sie in das Gewebe von Verdauungsorganen oder anderen Weichteilen im Körper. Dort schluckt es bei der anschliessenden Röntgenaufnahme oder einer Computertomographie (die auch mit Röntgenstrahlen gemacht wird) Strahlen, sodass die normalerweise kaum sichtbaren Organe nun deutliche Schatten werfen. Später werden die Kontrastmittel-Moleküle vom Körper selbst aufgeräumt und grösstenteils über die Niere wieder ausgeschieden.
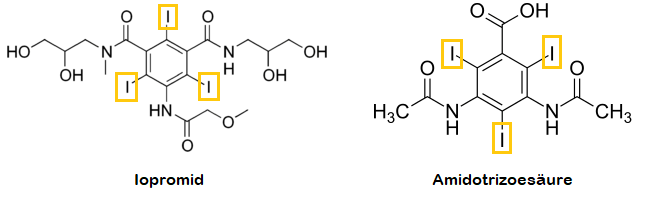
Zwei Beispiele für jodhaltige Kontrastmittel: Ähnlich wie in den Schilddrüsenhormonen sind Jod-Atome an ein Kohlenstoffgerüst gebunden (die Kohlenstoff(C-)-Atome zeichnet man der Übersicht halber nicht: jeder Winkel ohne Buchstabe steht für ein C-Atom). Und so, wie Jod-Atome von Schilddrüsenhormonen „abmontiert“ werden können, können in den Prozessen im menschlichen Körper auch diese Jod-Atome abmontiert werden – und bei entsprechender Vorerkrankung zu einer regelrechten Vergiftung führen.
Nebenwirkungen jodhaltiger Kontrastmittel
Eine typische Kontrastmitteldosis kann rund 15 bis 30 Gramm Jod enthalten. Das ist im Massstab für medizinische Wirkstoffe, die der Körper zu verarbeiten hat, eine gewaltige Menge! Der eigentliche Haken daran ist aber: Die Jodatome, die an die „Benzol“-Ringe solcher Moleküle gebunden sind, können im menschlichen Körper davon abgelöst (ich vermute: durch Austausch („Substitution“) gegen andere Atome oder Atomgruppen) werden. Das so freigesetzte Jod kann dann von der Schilddrüse aufgenommen werden – was dann zu einer gefährlichen Überladung mit Schilddrüsenhormonen führen kann, wenn der Patient eine Schilddrüsenüberfunktion hat oder sich in der Ausgangslage befindet, eine solche zu entwickeln. Deshalb sind jodhaltige Kontrastmittel für Patienten mit solchen Erkrankungen nicht – oder nur nach vorübergehender Blockade der Jodaufnahme durch die Schilddrüse – geeignet.
Ausserdem können jodhaltige Kontrastmittel – wie alle anderen grösseren körperfremden Moleküle auch – allergische Reaktionen auslösen. Wer solch eine Allergie hat, darf diese Art Kontrastmittel natürlich auch nicht verabreicht bekommen (Risikokandidaten mit anderen Allergien können vor einer unumgänglichen Kontrastmittel-Untersuchung vorsorglich allergiehemmende Mittel bekommen).
Jod als Desinfektionsmittel
Während jodhaltige Ionen in Salzen ein lebenswichtiger Nährstoff ist, hat elementares Jod, also solches, das aus I2-Molekülen besteht, geradezu gegenteilige Eigenschaften: Es ist sehr reaktionsfreudig und greift Körpergewebe und -zellen an. Aber nicht nur unsere, sondern auch die von Bakterien und anderen Krankheitserregern. Deshalb ist elementares Jod ein beliebtes Desinfektionsmittel.
Warum wirkt Jod desinfizierend?
Jod-Moleküle können im Zuge einer Redox-Reaktion einzelne Sauerstoff-Atome aus Wassermolekülen -die in Körpergewebe allgegenwärtig sind – herauslösen:
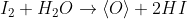
Diese Sauerstoff-Atome sind im Augenblick ihrer Freisetzung äusserst reaktionsfreudig (schliesslich fehlen ihnen je zwei Elektronen zu einem zufriedenstellenden (Edelgas-)Zustand) und greifen alles an, was ihnen in die Quere kommt, um sich irgendwie damit zu verbinden. Wenn das Kleinstlebewesen wie Bakterien sind, gehen die rasch daran zugrunde – wenn das menschliches Gewebe ist, reagiert das auf den Angriff mit Entzündungszeichen: Das Desinfizieren von Wunden mit Jod tut weh!
Was genau ist in jodhaltigen Desinfektionsmitteln drin?
Elementares Jod – ein fast schwarzer Feststoff – ist unlöslich in Wasser. Es gibt allerdings Tricks, mit deren Hilfe man Jod trotzdem mit Wasser mischen kann:
Entweder man mischt das Jod mit einer Kaliumiodid-Lösung. Die darin enthaltenen I–-Ionen lagern sich mit den I2-Molekülen zusammen und bilden spezielle und wasserlösliche Ionen aus je drei Jod-Atomen (I3–). Solche Lösungen werden deshalb auch „Kaliumtriiodid-Lösung“ genannt und sind im Schullabor sehr beliebt.
Oder man verwendet wasserlösliche organische Kettenmoleküle, die mit Triiodid-Ionen Komplexverbindungen eingehen können. Bei Bedarf (d.h. wenn ein attraktiverer Reaktionspartner zugegen ist) können sich die I2-Moleküle aus dem Komplex bzw. dem Triiodid lösen und ihrer desinfizierenden Aufgabe nachgehen. Solche organischen Komplexe findet ihr in jodhaltigen Medikamenten: Das „Polyvidon-Jod“ (kurz „Povidon-Jod“) in „Betaisodona“-Lösung oder -salbe ist einer davon.
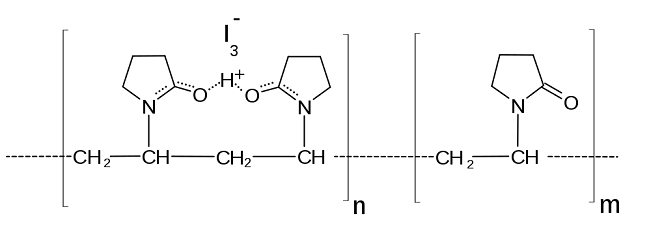
Das ist „Polyvidon-Iod“ – Rechts: Der Kunststoff Polyvidon (Polyvinylpyrrolidon, PVP) besteht aus langen Kohlenwasserstoff-Ketten, die mit ringförmigen Atomgruppen besetzt sind (n und m stehen für beliebige Anzahlen solcher Kettenglieder). Links: Die Sauerstoff-Atome von je zwei benachbarten Ringen können ein positiv geladenes Wasserstoff-Ion (H+) „tragen“, an welches ein negativ geladenes I3–-Ion bindet (denn entgegengesetzte Ladungen ziehen sich stets an).
Seiner aggressiven Wirkung auf Gewebe – vor allem auf Schleimhäute wegen – sind jodhaltige Desinfektionsmittel nur für die Anwendung „aussen“, d.h. auf der Haut bzw. zur Wundversorgung gedacht!
Jod als Reagenz zum Experimentieren
Im Schullabor ist der Nachweis von Stärke mit Jod (oder umgekehrt von Jod mit Stärke) sehr beliebt: Wenn man diese beiden zusammenbringt, bleiben die Jod-Moleküle nämlich in den langen Stärkeketten hängen und bilden mit ihnen eine tief blauschwarze Verbindung (Stärke ist dagegen weiss und jodhaltige Lösungen bräunlich).
Wie ihr die Stärke in Kartoffeln oder Pflanzenteilen zu Hause selbst nachweisen könnt – und zwar mit „Betaisodona“ oder einem ähnlichen Desinfektionsmittel! – zeige ich euch hier in meiner Sammlung spannender Experimente mit Pflanzen.

Mit Jodlösung – zum Beispiel aus einem Desinfektionsmittel – könnt ihr Stärke in Pflanzenteilen nachweisen!
Achtung! Jod als Element ist ein Gefahrstoff!
Achtet beim Experimentieren oder Aufbewahren von Jodlösungen stets darauf, dass ihr sie nicht mit Ammoniak (Ammoniakwasser, ammoniakhaltige Reinigungsmittel, Salmiak, Salmiakgeist…) zusammenbringt! Dabei können nämlich explosive Verbindungen aus Jod und Stickstoff entstehen, die ihr sicher nicht in eurer Wohnung oder im Schulzimmer haben wollt.
Bedenkt zudem immer: Elementares Jod wirkt auf nützliche Wasserlebewesen genauso wie auf schädliche Keime und unsere Schleimhäute. Deswegen darf es nicht ins Abwasser gelangen! Bringt Reste von Experimenten mit Jod ebenso wie abgelaufene jodhaltige Desinfektionsmittel immer zur Sonderabfall-Entsorgungsstelle!
Wenn ihr im Schullabor das Salz Natriumthiosulfat (oder ein anderes passendes Reduktionsmittel) zur Hand habt, könnt ihr Reste von Jodlösungen auch damit mischen: Die I2-Moleküle reagieren damit zu I–-Ionen (die braune Farbe der Lösung verschwindet dabei), die ins (Labor-)Abwasser entsorgt werden können.
Jod als umstrittener Stoff
Jod und Schilddrüsenüberfunktion
Bei bestimmten Schilddrüsenerkrankungen, speziell bei einer Überfunktion durch unkontrolliert hormonproduzierendes Gewebe, führt die Zufuhr von Jod zu einer Überproduktion von Hormonen, die in regelrechten Vergiftungserscheinungen münden kann: Auch deswegen ist es wichtig, die Behandlung von Schilddrüsenproblemen mit dem Arzt zu besprechen – denn der klärt die Art der Probleme ab und kann allenfalls vor solchen Schwierigkeiten warnen.
Gerne wird übrigens ein Zusammenhang zwischen entzündlichen Autoimmunerkrankungen der Schilddrüse wie Morbus Hashimoto ins Feld geführt. Ob es einen solchen gibt, konnte jedoch in klinischen Studien bislang nicht einwandfrei geklärt werden.
Gibt es eine Jodallergie?
Eine Überdosierung(!) von Jod kann generell die Bildung von Schilddrüsenhormonen beeinflussen bzw. zu allergieähnlichen Symptomen führen. Dann spricht man von einer Jod-Unverträglichkeit. Auch das ist ein Grund, weshalb eine Nahrungsergänzung mit zusätzlichen jodhaltigen Mitteln (über das Würzen mit Jodsalz und gewöhnliche Lebensmittel hinaus) sorgfältig auf den jeweiligen Körper und seinen Bedarf eingestellt werden sollte.
Aus diesem Grund wird der Zusatz von Jodsalzen zu Speisesalz und Futtermitteln nämlich so begrenzt, dass die Versorgung der Bevölkerung auf diesem Weg in der Schweiz wie auch in Deutschland bei „normaler“ Ernährung im unteren Soll-Bereich liegt – sodass eine Überversorgung durch jodierte Lebensmittel praktisch nicht möglich ist.
Eine „echte“ Jod-Allergie auf Kleinstmengen gibt es jedoch nicht (wie Allergien entstehen könnt ihr hier nachlesen): Sowohl I2-Moleküle als auch IO3– oder I– -Ionen sind zu klein für die Wechselwirkung mit Antikörpern, die jeder Allergie zu Grunde liegt.
Allergien gegen jodhaltige organische Moleküle – wie sie zum Beispiel als Kontrastmittel eingesetzt werden – sind dagegen möglich (weil solche Moleküle wesentlich grösser sind als die der anorganischen Jodverbindungen) und bekannt.
Mein Fazit
Jod ist ein vielseitiges Element und in seinen Verbindungen ein für den menschlichen Körper unverzichtbares Spurenelement. Mit der Jodversorgung steht und fällt der Schilddrüsenstoffwechsel, der von grösster Bedeutung für unseren Energiehaushalt und die gesunde Entwicklung von Kindern ist.
Deshalb tun die Verantwortlichen in Ländern mit jodarmen Böden – wie der Schweiz und Deutschland – gut daran, für den Zusatz von Jod zu Speisesalz und Nahrungsmitteln zu sorgen. So kommen wir nämlich zu unserem Jod, ohne zusätzliche Kosten und Mühe mit speziellen Nahrungsergänzungsmitteln auf uns nehmen zu müssen. Zudem wird der Zusatz von Jod zu Lebensmitteln so gesteuert, dass eine Überdosierung, die zu Symptomen einer Jodunverträglichkeit führen kann, auf diesem Wege höchst unwahrscheinlich ist.
Elementares Jod hat dagegen ganz andere – aggressivere – Eigenschaften und findet deshalb als Desinfektionsmittel Verwendung, während es zur Einnahme nicht geeignet ist!